Estrutura da matéria: Atomística (modelos atômicos e distribuição eletrônica)

PURA ENERGIA LIBERADA O efeito luminoso da queima de fogos de artifício é causado pelo movimento de vaivém de elétrons em torno do núcleo
A química dos átomo
O modelo aceito pela química hoje prevê que um átomo é composto de um núcleo com prótons e nêutrons, cercado por uma nuvem de elétrons
Tudo o que existe no Universo – as estrelas, como o Sol, as rochas, a água de rios e oceanos e os seres vivos – é feito de matéria. E toda matéria é constituída de átomos. O átomo é uma unidade básica da matéria, formada por um núcleo rodeado por uma nuvem de partículas. Ou seja, o átomo é como um tijolo da matéria, mas contém partículas ainda menores. Esse conceito surgiu apenas no século XIX, com a criação dos primeiros modelos atômicos. Isso dependeu de uma grande mudança na forma como o mundo era observado e analisado.
Modelos atômicos
Ciências que estudam a natureza, como a química, a física e a biologia, têm sua atividade baseada no método científico, uma série de etapas que precisam ser cumpridas rigorosamente, ao fm das quais é possível chegar a conclusões sólidas sobre o fenômeno estudado.
O pesquisador observa um fenômeno, define a questão a ser respondida, faz medidas, coleta e compara dados. Com isso ele formula uma possível explicação para o fenômeno – uma hipótese, que precisa ser testada. Se a hipótese se comprova válida, o pesquisador pode generalizar a ideia, na forma de uma lei científica ou de um conjunto de leis que constituem uma teoria. Para fenômenos que não podem ser observados nem medidos, a teoria é denominada modelo – uma analogia que permite a explicação do fenômeno. Foi o que aconteceu no século XVIII, quando os cientistas começaram a se questionar sobre a estrutura dos átomos.
Átomos são partículas minúsculas, impossíveis de serem vistas mesmo pelos equipamentos mais sofisticados. Daí a necessidade de construir um modelo que explique a estrutura atômica.
O modelo de Dalton

O inglês John Dalton foi um dos pioneiros a pesquisar os átomos de maneira científica, no início do século XIX. Ele analisou os resultados de experimentos realizados por dois franceses – Antoine Laurent Lavoisier e Joseph Louis Proust. Essas experiências afastavam o caráter mágico das reações químicas e propunham uma explicação racional para o fenômeno. Dalton criou um modelo atômico, muito baseado no conceito grego antigo. Para o inglês,
• o átomo é uma esfera maciça e indivisível;
• toda matéria é formada por átomos, partículas indivisíveis;
• átomos de um mesmo elemento são iguais em massa e propriedades; átomos de elementos 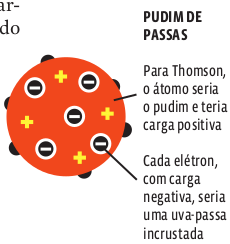 diferentes têm distintas massa e propriedades;
diferentes têm distintas massa e propriedades;
• os compostos são formados de átomos que se combinam em proporção simples.
O modelo de Thomson
Na segunda metade do século XIX, experimentos com gases que recebem descargas elétricas indicaram que o átomo continha partículas com carga elétrica negativa. No fim do século, outro inglês, Joseph John Thomson, descobriu a primeira partícula subatômica – o elétron. Isso provou que o átomo não é indivisível, mas composto de partículas menores. Thomson propôs, então, um novo modelo atômico, que foi apelidado de pudim de passas.
O modelo Rutherford-Böhr
O modelo atômico aceito atualmente pela química começou a ser esboçado por Ernest Rutherford, no início do século XX. O pesquisador inglês bombardeou uma lâmina finíssima de ouro (com 10 –4 mm de espessura) com partículas alfa, emitidas por um material radiativo. Rutherford sabia que as partículas alfa têm carga elétrica positiva e, no experimento, constatou que a maioria das partículas alfa atravessava a lâmina de ouro sem sofrer nenhum desvio de trajetória. Mas algumas delas se desviavam ou eram rebatidas de volta ao colidir com a lâmina de ouro.
E, com base nessas observações, Rutherford chegou às seguintes conclusões:
• se a maioria das partículas alfa atravessou a lâmina sem se desviar, os átomos da lâmina de ouro deviam ter grandes espaços vazios;
• se algumas partículas alfa foram rebatidas, então os átomos da lâmina deviam apresentar uma parte central muito pequena e densa – um núcleo;
• por fim, se outra parte das partículas alfa (que têm carga positiva) sofreu algum desvio ao atravessar a lâmina, então o núcleo dos átomos de ouro deve ter carga positiva (lembre-se de que cargas iguais se repelem).
Com essas hipóteses, Rutherford só precisou raciocinar: para equilibrar a carga elétrica positiva do núcleo, os vazios deviam ser povoados de elétrons, de carga negativa. Daí surgiu o modelo atômico de Rutherford, que foi aperfeiçoado pelo dinamarquês Niels Böhr, poucos anos depois. Esse modelo lembra o formato do sistema solar, com o núcleo representando o Sol e os elétrons, os planetas. Nos anos 1930, os nêutrons, sem carga elétrica, foram descobertos e incorporados ao modelo.
Com a descoberta do nêutron, o átomo teve seu modelo completado. Hoje, são bem conhecidas as propriedades fundamentais de cada uma dessas partículas.
Diferenças e semelhanças

São os prótons, no núcleo atômico, que definem um elemento químico. Cada elemento químico tem um nome e é representado por um símbolo, que indica seu nome. Esse símbolo é composto de uma ou duas letras (sempre começando com maiúscula e terminando com minúscula), que muitas vezes se referem ao nome do elemento em latim. Veja alguns exemplos:

Prótons e nêutrons
O número de prótons é chamado número atômico (Z). Por exemplo:
• para o átomo de ferro (Fe), que contém 26 prótons, Z = 26;
• para o sódio (Na), com 11 prótons, Z = 11.
A soma do número de prótons (p) e o número de nêutrons (n) é o número de massa (A). O número de prótons é o mesmo que o número atômico. Então:
A = Z + n
A proporção entre o número de prótons e o de nêutrons define algumas semelhanças e diferenças entre os átomos:
• ISÓTOPOS São átomos com o mesmo número
de prótons, mas com diferente número de nêutrons. Se têm o mesmo número de prótons, esses átomos têm o mesmo número atômico Z e, portanto, são um mesmo elemento, com propriedades químicas semelhantes. Mas, devido à variação no número de nêutrons, suas propriedades físicas podem diferir ligeiramente. Veja, como exemplo, os isótopos do cálcio (Ca):
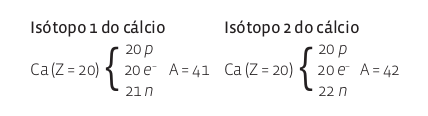
Os isótopos de um elemento químico não recebem nomes especiais. São identificados apenas como “isótopo”. No caso do cálcio, por exemplo:


O único elemento químico cujos isótopos recebem nomes especiais é o hidrogênio. Veja:

• ISÓBAROS São átomos de elementos químicos diferentes que têm o mesmo número de massa (A). Nesse caso, eles diferem tanto em suas propriedades químicas quanto nas físicas. O cálcio (Ca), por exemplo, é isóbaro do potássio (K). Veja:
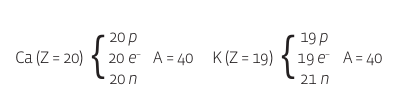
Repare que o número de prótons (Z) do cálcio é diferente do número de prótons do potássio. Então eles são elementos químicos distintos. Ainda assim, têm o mesmo número de massa (A). A diferença está no número de nêutrons.
• ISÓTONOS São átomos de elementos químicos distintos que têm diferentes número de massa (A) e número atômico (Z), mas apresentam o mesmo número de nêutrons (n). Nesse caso, a diferença está no número de prótons. São isótonos:

Elétrons
O número de elétrons (e – ) e a relação entre esse número e a quantidade de prótons, no núcleo, também definem propriedades químicas importantes de um átomo. Íons são átomos que ganham ou perdem elétrons numa ligação química. A maioria dos átomos liga-se uns aos outros, a fim de alcançar a estabilidade. Se, numa ligação, um átomo cede elétrons, é um íon positivo; se recebe elétrons, é chamado íon negativo. Veja:
• CÁTIONS É o nome que se dá aos íons positivos – ou seja, átomos que perderam elétrons e, portanto, têm mais cargas positivas (dadas pelos prótons). O total de elétrons cedidos é sempre igual ao total de cargas negativas perdidas. Veja, no exemplo abaixo, como um átomo neutro de cálcio se transforma num cátion:

<
• Ca é o átomo de cálcio
• Ca 2+ é como se representa o cátion bivalente de cálcio (com dois elétrons a menos). Esse tipo de notação vale para qualquer cátion.
• ÂNIONS São átomos eletrizados negativamente – ou seja, com mais cargas negativas (elétrons) do que cargas positivas (prótons). Para que um átomo neutro se torne um ânion, ele tem de ganhar elétrons. O total de elétrons recebidos é sempre igual ao total de cargas negativas adquiridas. Veja como um átomo neutro de nitrogênio (N) se transforma em ânion:

•N é o átomo de nitrogênio
• N 3– é como se representa o ânion trivalente do nitrogênio (com três elétrons a mais). Esse tipo de notação vale para qualquer ânion.
Átomos neutros ou íons de elementos químicos diferentes podem apresentar o mesmo número de elétrons. Quando isso ocorre, dizemos que esses átomos são isoeletrônicos.
A organização dos elétrons
A região ocupada pela nuvem de elétrons, em torno do núcleo, chama-se eletrosfera. Em 1913, Niels Böhr fez uma série de experimentos que resultaram nos seguintes postulados a respeito da eletrosfera:
• os elétrons se movimentam em trajetórias circulares, chamadas camadas ou níveis de energia. Cada um desses níveis tem um valor energético;
• quanto mais externo for o nível, mais energia ele tem;
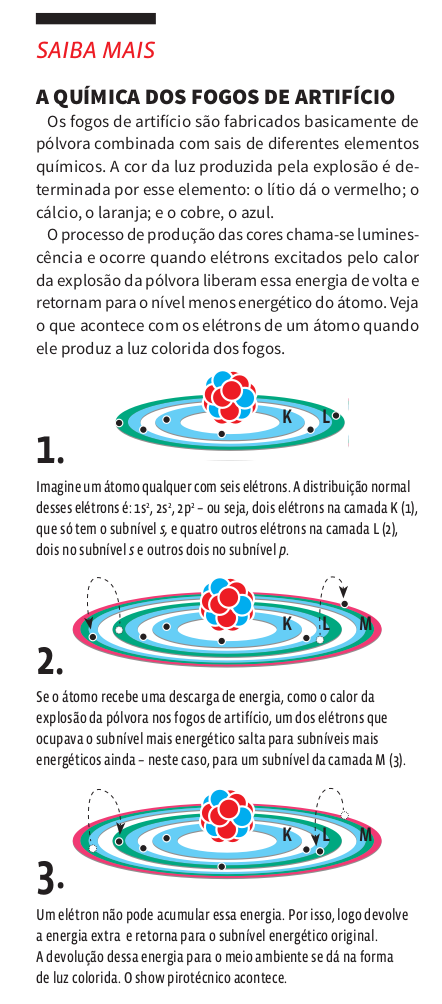
• um elétron que absorve energia (elétrica, luz, calor, por exemplo) salta de uma camada mais interna para outra mais externa;
• um elétron que volta à sua camada interna original libera a energia recebida na forma de ondas eletromagnéticas.
A ciência conhece sete níveis de energia, que podem abrigar até 112 elétrons. Por isso, dizemos que a eletrosfera se divide em sete camadas eletrônicas, cada uma delas com o máximo possível de elétrons. Veja:
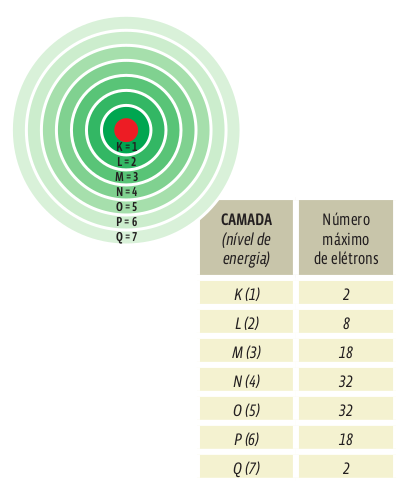
Configuração eletrônica
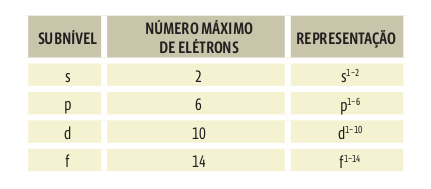
Cada nível de energia da eletrosfera contém diversos subníveis, identificados pelas letras minúsculas s, p, d, f. Cada subnível comporta um número máximo de elétrons.
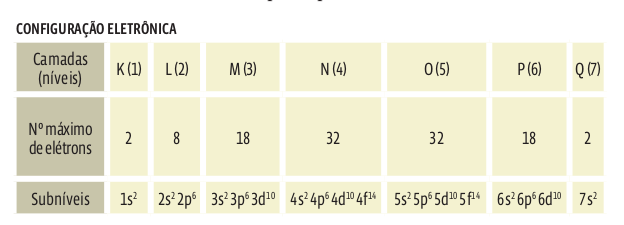
A forma como os elétrons se distribuem pelos subníveis é chamada configuração eletrônica. Veja a tabela abaixo e acompanhe o raciocínio para entender, passo a passo, como os elétrons se dispõem pelas camadas e subníveis:
• Cada subnível comporta um número máximo de elétrons:
s = 2
p = 6
d = 10
f = 14
•A camada 1 tem apenas o subnível s, onde cabem, no máximo, dois elétrons.
• A camada 2 comporta oito elétrons, em dois subníveis, s e p. Dois elétrons lotam o subnível s. Os outros seis elétrons vão para o subnível p.
• A camada 3 tem três subníveis: s, p e d. Os subníveis s e p já contêm oito elétrons. A camada comporta mais dez elétrons, no subnível d. No total, o nível M comporta 18 elétrons.
• As camadas 4 e 5 comportam 32 elétrons cada uma, em quatro subníveis: s, p, d e f.

FERNANDO GONSALES
A energia de um elétron depende da camada e do subnível que ele ocupa. Num átomo no estado fundamental (sem elétrons excitados por alguma forma de energia), os elétrons se distribuem em ordem crescente seguindo as diagonais do diagrama de Linus Pauling. Veja:
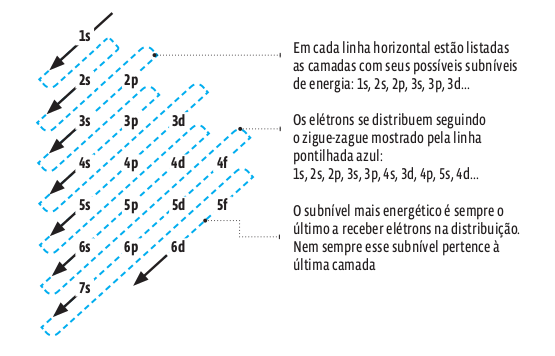
Veja como se distribuem os elétrons do hidrogênio e do sódio. O hidrogênio neutro (H) tem apenas um próton e um elétron (não contém nêutrons). Então:
• Esse elétron só pode estar na camada K (1);
• Como essa camada tem apenas um subnível energético, a localização do elétron tem de ser 1s 1
Para o sódio (Na), com 11 elétrons, o raciocínio é o mesmo:
• Os elétrons vão se distribuindo pelas camadas e, em cada uma delas, pelos subníveis, seguindo o zigue-zague de Linus Pauling:
1s 2 , 2s 2 , 2p 6 e 3s 1
Os elétrons mais energizados estão no último subnível. Mas preste atenção no zigue-zague: nem sempre o último subnível está na última camada. Essa é a camada de valência, que contém os elétrons que participam das ligações químicas.
Repare na distribuição de elétrons do ferro e do bromo. Para o ferro (Z = 26):
•Subníveis: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6
• Níveis: K = 2 L = 8 M = 14 N = 2
• Subnível mais energético: 3d, com 6 elétrons
• Camada de valência • 4 (4s) com 2 elétrons
Para o bromo (Z = 35):
• Subníveis: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5
• Níveis: K = 2 L = 8 M = 18 N = 7
• Subnível mais energético: 4p, com 5 elétrons
• Camada de valência • 4 (4s 2 e 4p 5 ) com 7 elétrons
Os elétrons perdidos por um cátion (íon positivo)são sempre aqueles da camada de valência, e não do último subnível de distribuição. Então, para identificar os elétrons que o cátion cede, você deve:
1. distribuir os elétrons do átomo neutro, segundo as camadas e os subníveis (em zigue-zague);
2. identificar a camada de valência e dela retirar os elétrons cedidos a outro átomo.