Estrutura da matéria: Estados físicos, propriedades gerais, substâncias e misturas
De que o mundo é feito
Composto de uma única substância ou de uma mistura, todo material tem propriedades gerais e específicas
Praticamente tudo o que vemos, tocamos e sentimos pelo olfato ou pelo paladar são compostos químicos, ou uma mistura de diferentes compostos. Naturais ou sintetizados (produzidos em laboratório), todos os materiais são genericamente chamados de matéria.
Na física, a matéria é estudada como um corpo cujo comportamento é analisado sob determinadas forças ou certos campos de força. Por exemplo, como se comporta um veículo quando acelerado ou freado.
Já a química estuda a matéria, sua estrutura e propriedades sob pontos de vista diferentes.
Para a química, o que importa são
• a composição da matéria,
• as transformações por que a matéria passa e
• a energia envolvida nessas transformações.
Estados da matéria
Tanto para a física quanto para a química, o estado físico de um material é fundamental para sua identificação. A matéria pode
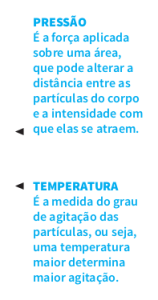
estar no estado sólido, líquido ou gasoso, dependendo do grau de agitação das partículas que a constituem e da intensidade de atração entre elas.
• No estado sólido, as partículas estão organizadas de maneira harmoniosa e sob alto grau de atração, mas agitam-se pouco. Por isso os sólidos têm forma e volume fixos.
• No estado líquido, a atração entre as partículas ainda é grande, mas seu grau de agitação aumenta um pouco. Não é possível
manter as partículas organizadas. Daí que os líquidos têm volume constante, mas tomam a forma do recipiente que os contém.
• No estado gasoso, a atração entre as partículas é mínima, e o grau de agitação é muito grande. Gases alteram seu volume conforme o recipiente que os contém.
Todo material assume este ou aquele estado físico, dependendo da pressão e da temperatura em que se encontra. Mas cada material reage de um modo diferente ao aumento ou à diminuição da temperatura ou da pressão.
PROPRIEDADES GERAIS
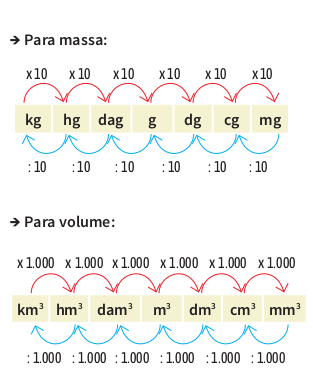
A química utiliza diversos conceitos da física. Um deles é a massa – a grandeza que mede a quantidade de matéria existente em um corpo. A massa é medida mais comumente em gramas (g) e seus múltiplos ou submúltiplos, como quilograma (kg), miligrama (mg) etc.
Outro conceito da física importante para a química é o volume – a grandeza que mede o espaço ocupado por certa massa de
matéria. As unidades mais comuns para volume são o metro cúbico (m 3 ), o litro (L) e seus múltiplos e submúltiplos, como centímetro cúbico (cm 3 ), quilômetro cúbico (km 3 ), decilitro (dL) e centilitro (cL). É comum, nas questões de vestibular e Enem, que você precise fazer a conversão de unidades. Veja algumas relações entre as unidades de volume:

Massa e volume não são suficientes para identificar um tipo de matéria. Isso depende de outras características e propriedades específicas.
• Densidade: Outra propriedade específica da matéria – a relação entre a massa de um material e o volume por ele ocupado. Matematicamente:
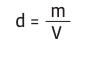
A unidade adotada para a densidade pode ser grama por centímetro cúbico, grama por litro, ou quilograma por litro (g/cm 3 , g/L ou kg/L). Se o alumínio tem densidade de 2,7 g/cm 3 , então, cada centímetro cúbico de alumínio tem massa de 2,7 gramas.
É a diferença de densidade que faz com que alguns materiais flutuem sobre outros. E isso ocorre também entre materiais de mesma natureza – a água, por exemplo. No estado líquido, a água tem densidade de 1 g/cm 3 . Já no estado sólido, a densidade da água cai para 0,92 g/cm 3 .
Por isso, pedaços de gelo boiam num copo com refrigerante. Já o ferro em barra (portanto, no estado sólido) tem densidade muito maior que a água, de 7,86 g/cm 3 . Por isso, afunda.
• Solubilidade É a quarta característica importante dos materiais – quanto o material é capaz de se dissolver em água a determinada temperatura. Quanto maior é a solubilidade de uma substância, mais solúvel ela é. Pode se medir a solubilidade de uma substância (soluto) em qualquer outra substância (solvente), mas a medida mais importante é em relação à água.
O máximo de cloreto de sódio (sal de cozinha) que se consegue dissolver em 100 g de água, a 20 °C, é 36 g. Além dessa proporção, acumulam-se grãos de sal no fundo do recipiente. Já de sacarose (açúcar) podem-se dissolver no mesmo volume de água, à mesma temperatura, 204 g. Isso significa que o açúcar é mais solúvel em água do que o sal.
Propriedades específicas
Cada tipo de material tem propriedades específicas, que ajudam em sua identificação. Algumas das principais propriedades específicas de um material são:
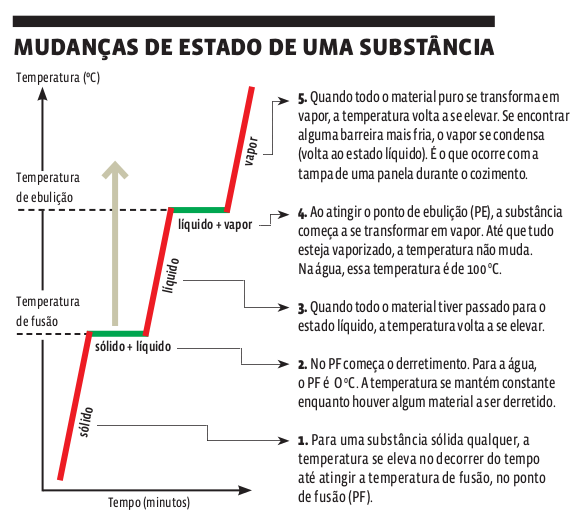
• Ponto de fusão (PF): É a temperatura na qual ocorre a fusão durante o aquecimento (ou a solidificação durante o resfriamento) de um material submetido a uma pressão constante.
• Ponto de ebulição (PE): É a temperatura na qual ocorre tanto a ebulição (durante o aquecimento) quanto a condensação/ liquefação (durante o resfriamento) de um material submetido a pressão constante.
Os pontos de fusão e ebulição de cada substância são determinados experimentalmente. Como a temperatura varia conforme a pressão, esses pontos são sempre definidos, por padrão, ao nível do mar, onde a pressão é de 1 atmosfera. Veja abaixo os pontos de fusão e de ebulição de alguns materiais.
1 atmosfera É a pressão exercida pela atmosfera terrestre ao nível do mar. Equivale a 760 milímetros de mercúrio (760 mm Hg).
• Densidade: Outra propriedade específica da matéria – a relação entre a massa de um material e o volume por ele ocupado. Matematicamente:
MAIS LEVE QUE A ÁGUA No Mar Morto, a concentração de sais diluídos é tão alta que a densidade da água sobe de 1,03
kg/L para 1,24 kg/L . Parece pouco, mas isso é suficiente para sustentar uma pessoa sem nenhuma boia.
A unidade adotada para a densidade pode ser grama por centímetro cúbico, grama por litro, ou quilograma por litro (g/cm 3 , g/L ou kg/L). Se o alumínio tem densidade de 2,7 g/cm 3 , então, cada centímetro cúbico de alumínio tem massa de 2,7 gramas.
É a diferença de densidade que faz com que alguns materiais flutuem sobre outros. E isso ocorre também entre materiais de mesma natureza – a água, por exemplo. No estado líquido, a água tem densidade de 1 g/cm 3 . Já no estado sólido, a densidade da água cai para 0,92 g/cm 3 . Por isso, pedaços de gelo bóiam num copo com refrigerante. Já o ferro em barra (portanto, no estado sólido) tem densidade muito maior que a água, de 7,86 g/cm 3 . Por isso, afunda.
• Solubilidade É a quarta característica importante dos materiais – quanto o material é capaz de se dissolver em água a determinada temperatura. Quanto maior é a solubilidade de uma substância, mais solúvel ela é. Pode – se medir a solubilidade de uma substância (soluto) em qualquer outra substância (solvente), mas a medida mais importante é em relação à água.
O máximo de cloreto de sódio (sal de cozinha) que se consegue dissolver em 100 g de água, a 20 °C, é 36 g. Além dessa proporção, acumulam-se grãos de sal no fundo do recipiente. Já de sacarose (açúcar) podem-se dissolver no mesmo volume de água, à mesma temperatura, 204 g. Isso significa que o açúcar é mais solúvel em água do que o sal.
Densidade
Um balão de festa que se enche por sopro não permanece flutuando porque o ar que sopramos é mais denso do que o ar atmosférico do lado externo do balão. O ar da atmosfera é uma mistura de gases com densidade de 1,2 g/L. Já a mistura que expiramos contém uma boa proporção de gases mais densos – principalmente o gás carbônico, que tem densidade de 1,8 g/L. Coisa bem diferente acontece com um balão cheio de gás hélio. Como tem densidade muito menor que a do ar atmosférico (0,16 g/L), o balão vence até mesmo a gravidade e sobe.
Substância e mistura
As propriedades específicas só nos auxiliam a identificar um material se a amostra for composta de uma única substância. Misturas de substâncias não têm suas características tabeladas porque elas dependem da proporção em que seus componentes estão misturados. Nesse caso, os químicos e físicos só têm três atitudes a tomar: experimentar, observar e comparar.
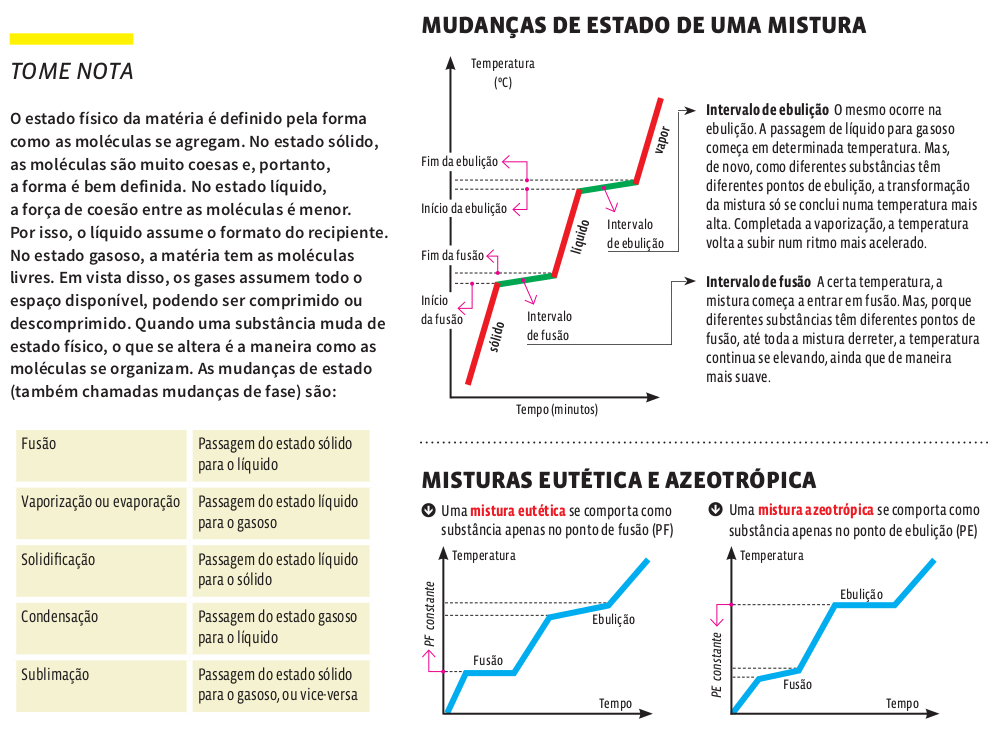
Uma substância é uma mistura composta de partículas de mesmo tipo. As substâncias têm comportamento muito característico: à medida que a temperatura cai ou sobe, podem mudar de estado físico. Mas, durante essa mudança, a temperatura do material não se altera. Já numa mistura – um material formado por duas ou mais substâncias –, as mudanças de estado acontecem numa temperatura que se altera. Compare, nos gráficos ao lado, o comportamento de substâncias e de misturas, durante a mudança de estado.
Algumas misturas se comportam como substâncias em uma das mudanças de estado, mas nunca nas duas. As que apresentam variação de temperatura no PE são chamadas misturas estéticas. Aquelas para as quais a temperatura varia no PF são chamadas misturas azeotrópicas. Os gráficos ao lado representam as mudanças de estado desses dois tipos de mistura.
Classificação das misturas
Na natureza, é muito raro encontrarmos substâncias com grau de pureza total. Quase tudo é mistura, mesmo quando ela não é facilmente percebida. É o caso do ar atmosférico. O ar é uma mistura de diversos gases, como nitrogênio, oxigênio e gases nobres.
Se estiver poluído, o ar contém, ainda, boa concentração de outras substâncias, como partículas de fuligem ou monóxido de carbono. O mesmo acontece com a água: na natureza, costuma carregar sais minerais. Nas torneiras das cidades brasileiras, ela vem misturada ao flúor, que ajuda a proteger os dentes contra as cáries.
Na indústria, também é raro o uso de substâncias absolutamente puras. Os metais preciosos, como prata e ouro, são extraídos misturados a outras substâncias minerais e têm de ser purificados antes da fabricação de qualquer peça, como jóias. Mas porque são muito moles, precisam ser combinados com outros metais, em ligas que permitem a moldagem das peças.
Qualquer porção de matéria separada para estudo e análise chama-se sistema. A primeira observação a ser feita na classificação de um sistema é se ele é homogêneo ou heterogêneo. Sistema homogêneo é aquele em que existe uma única fase (são monofásicos ou unifásicos). Em oposição, sistema heterogêneo é aquele que apresenta mais de uma fase (são polifásicos).
Todas as substâncias puras constituem sistemas homogêneos. A não ser quando estão em diferentes estados físicos ou em mudança de estado – aí, comportam-se como sistemas heterogêneos. Nas fotos ao lado, você confere alguns sistemas homogêneos e heterogêneos.
As soluções também são misturas que apresentam apenas uma fase – ou seja, são sistemas homogêneos. É o caso de uma xícara de chá.



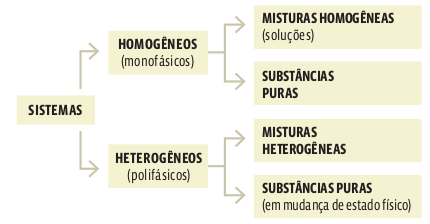

• Todo sistema gasoso é homogêneo, não importa a quantidade deste ou daquele gás na mistura.
• Todo sistema sólido é heterogêneo. Uma exceção apenas: as ligas metálicas são misturas homogêneas.