Transformações: Reações químicas

A cor como testemunha. A reação de uma solução de nitrato de chumbo com outra, de iodeto de potássio, produz o amarelíssimo iodeto de chumbo.
O que são reações, os fatores que podem provocá-las e os indicadores de que uma delas ocorreu
Você já viu, nas aulas anteriores, que as substâncias são formadas de átomos; esses átomos se juntam em moléculas ou num retículo cristalino; e essa junção atômica se dá por meio de ligações químicas.
Agora você vai ver que, quando as ligações químicas são quebradas, ocorre uma reação química; numa reação, as substâncias originais (reagentes) se recombinam e dão origem a outras substâncias (produtos). Numa reação química, a estrutura da matéria é alterada. Mas ainda identificamos os átomos que compõem cada substância. Por exemplo, numa molécula de água, identificamos perfeitamente os elementos químicos hidrogênio e oxigênio que a compõem.
Uma reação ocorre quando as ligações químicas se rompem. Isso se dá quando a quantidade de energia num sistema é alterada. Essa mudança pode acontecer por diversos meios, como a alteração da temperatura, a mistura de substâncias que funcionam como catalisadores, a incidência de luz ou a passagem de corrente elétrica.
Balanceamento de equações químicas




Uma reação é representada como equação química. Assim como ocorre nas receitas de culinária, uma reação depende não apenas dos ingredientes (reagentes), mas também da proporção em que esses ingredientes são empregados. Veja o que ocorre com a reação dos gases oxigênio (O2) e hidrogênio (H2), que resulta em água (H2O):
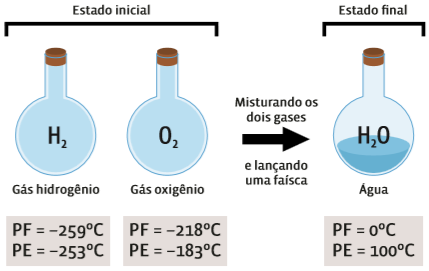
Repare que o produto da reação acima (a água) tem propriedades muito diferentes das dos reagentes – estado físico, pontos de fusão (PF) e de ebulição (PE). Então houve uma reação química. Mas a natureza dos átomos não se alterou: o oxigênio continua endo oxigênio, e o hidrogênio, hidrogênio.
Assim como as equações matemáticas, as quantidades de um lado da equação devem ser iguais às quantidades do outro lado. Então, para escrever a equação de uma reação, é preciso:
→ Conhecer a fórmula dos reagentes;
→ Conhecer a fórmula dos produtos; e
→ Verificar se a quantidade de átomos de um lado da equação (dos reagentes) é igual à quantidade de átomos do outro lado (dos produtos).
Na reação que resulta em água, sabemos que a água é produto da reação dos gases hidrogênio e oxigênio. E conhecemos a fórmula de cada
uma dessas substâncias. Veja:
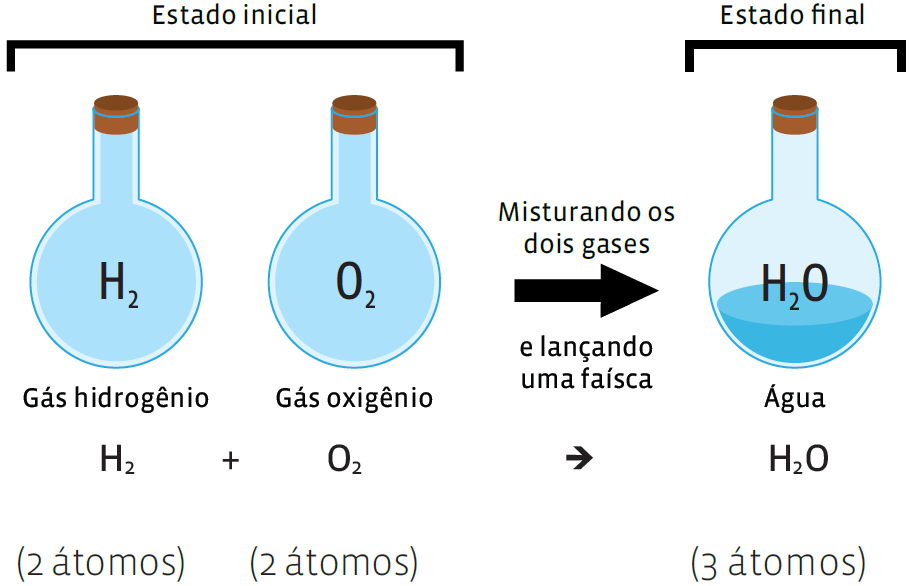
No entanto, repare: o número de átomos do produto (H2O) é diferente do número de átomos dos reagentes. Falta um átomo de oxigênio. Para igualar esse número, temos de fazer o balanceamento da equação. Isso é feito acrescentando-se coeficientes. O coeficiente não altera o número de átomos, mas de moléculas:
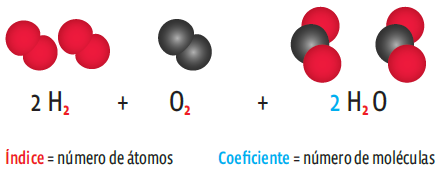
Repare que agora temos duas moléculas de hidrogênio (com dois átomos cada uma) e uma molécula de oxigênio (também com dois átomos cada uma). O produto são duas moléculas de água. O número de átomos se mantém dos
dois lados: quatro átomos de hidrogênio e dois átomos de oxigênio.
No balanceamento de uma equação jamais se mexe nos índices – ou seja, jamais se altera o número de átomos. Fazer isso significa alterar a substância. Por exemplo: H2O é uma molécula de água. Mas H2O2 é peróxido de hidrogênio, a
água oxigenada.
Índices : O índice é também chamado atomicidade, porque indica o número de átomos de um composto.
O balanceamento de uma equação explica muita coisa. Por exemplo, o metano (CH4), que contribui para o aquecimento global ao intensificar o efeito estufa. Veja a reação referente a esse fenômeno químico:
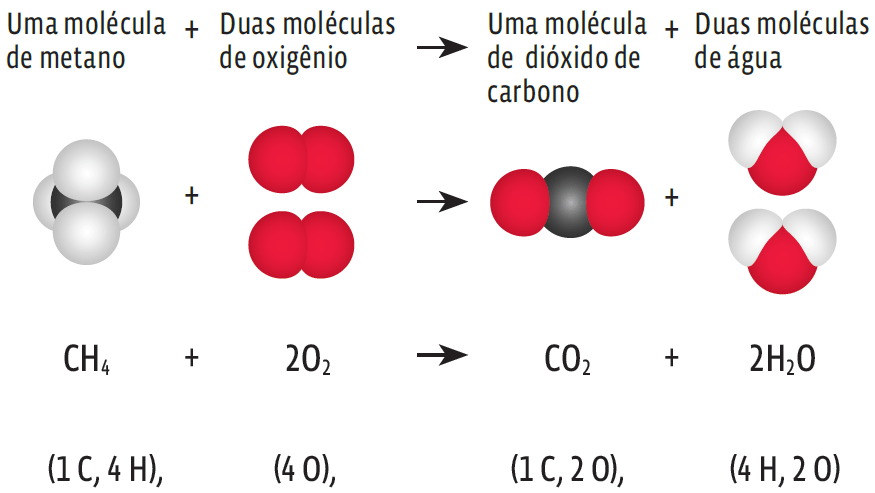
Note que:
- → O número de átomos de carbono e de hidrogênio permanece o mesmo, dos dois lados da equação (1 C) e (4 H);
- → O mesmo acontece com o oxigênio: os quatro átomos existentes no início da reação se mantêm no produto;
- → Só que, no produto, os átomos de oxigênio se separam: dois deles compõem o dióxido de carbono (CO2); os outros dois entram em duas moléculas de água (2 H2O).
BALANCEAMENTO
Algumas dicas para fazer o balanceamento de uma equação. Vamos balancear a seguinte equação:

• Passo 1: comece o balanceamento pelos elementos que aparecem apenas uma vez de cada lado da equação. No caso, o hidrogênio (H) e o carbono (C).
• Passo 2: para balancear o carbono (C), que tem 2 átomos de um lado, temos de mudar o coeficiente do outro lado:
C2H6O + O2 → 2 CO2 + H2O
• Passo 3: de hidrogênio (H), há seis átomos de um lado e apenas dois de outro. Para balancear, vamos de novo aplicar o coeficiente adequado:
C2H6O + O2 → 2 CO2 + 3 H2O
• Passo 4: conferimos se o número de átomos dos demais elementos está igual dos dois lados. Neste caso, temos três átomos de oxigênio entre os reagentes e sete deles no produto. Então, temos de alterar o coeficiente de um dos reagentes:
C2H6O + 3 O2 → 2 CO2 + 3 H2O

Nas provas, as questões sobre balanceamento costumam fornecer no enunciado a fórmula das substâncias ou compostos envolvidos na reação. Mas, em alguns casos, os examinadores consideram esse dado como conhecido pelo aluno. Vale a pena, então, memorizar as fórmulas de compostos mais comuns.
Tipos de reações
As reações podem ser classificadas por diferentes critérios. Alguns dos principais tipos são:
→ Reação de síntese ou adição
Duas ou mais substâncias resultam num único produto. Genericamente:
A + B → C
São reações de síntese:
H2 + Cl2 → 2 HCl
2 CO + O2 → 2 CO2
CaO + H2O → Ca(OH)2
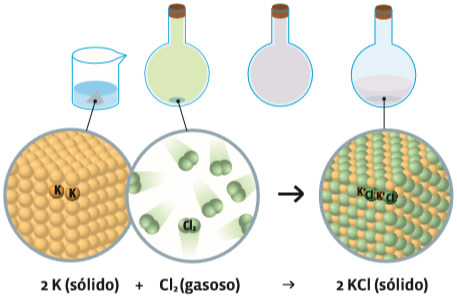
Síntese O potássio é sólido e tem estrutura cristalina. O cloro tem estrutura molecular. A combinação das duas substâncias provoca uma reação que sintetiza uma terceira substância, o cloreto de potássio. Esse cloreto é sólido e de estrutura cristalina, mas diferente da estrutura de qualquer um dos reagentes
→ Análise ou decomposição
Nesse tipo de reação, um único composto se separa em substâncias mais simples quando é submetido a calor, corrente elétrica ou luz. Genericamente:
A → B + C
Dependendo do agente físico usado, a decomposição recebe nomes diferentes. Uma decomposição obtida por calor é chamada pirólise (piros = fogo e lise = quebra). A resultante da passagem de corrente elétrica é eletrólise, e a produzida por luz, fotólise.
Constituem reações de decomposição:
(NH4)2Cr2O7 → Cr2O3 + 4 H2O + N2 (pirólise)
2 H2O2 → 2 H2O + O2 (fotólise)
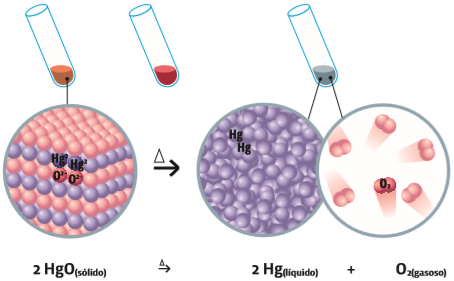
Decomposição O óxido de mercúrio é um sólido de estrutura cristalina. O símbolo ∆ sobre a seta, na figura, representa aquecimento. Se o óxido de mercúrio é aquecido, a substância se decompõe em seus elementos originais: mercúrio e oxigênio
→ Deslocamento ou simples troca
Uma substância simples reage com uma substância composta (constituída de vários elementos). Nessa reação, a substância simples desloca (ou seja, substitui) um elemento da substância composta. Genericamente:
A + BC → AC + B
São reações de deslocamento:
Cl2 + 2 KI → 2 KCl + I2
Zn + 2 AgNO3 → Zn(NO3)2 + 2 Ag
Br2 + (NH4)2S → 2 NH4Br + S
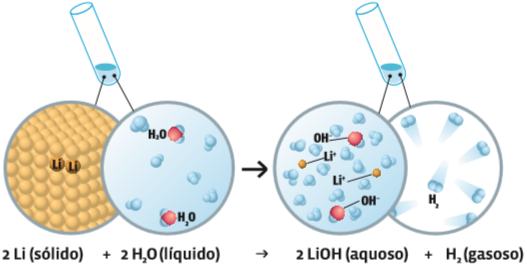
Simples Troca Na reação entre o lítio e a água, os átomos de hidrogênio e oxigênio da água se separam. O lítio se combina com o oxigênio e com parte dos átomos de hidrogênio para formar o hidróxido de lítio, em solução aquosa. Outra parte dos átomos de hidrogênio se recombina de dois em dois, constituindo o gás hidrogênio
→ Dupla troca
Íons de cargas iguais trocam de posição, produzindo outros dois compostos. Genericamente:
AB + CD → AD + CB
São reações de dupla troca:
HNO3 (aq) + KCN (aq) → KNO3 (aq) + HCN (g)
3 Ca(OH)2 (aq) + 2 FeCl3 (aq) → 3 CaCl2 (aq) + 2 Fe(OH)3 (s)
H2SO4 (aq) + 2 NaOH(aq) → Na2SO4 (aq) + 2 H2O (l)
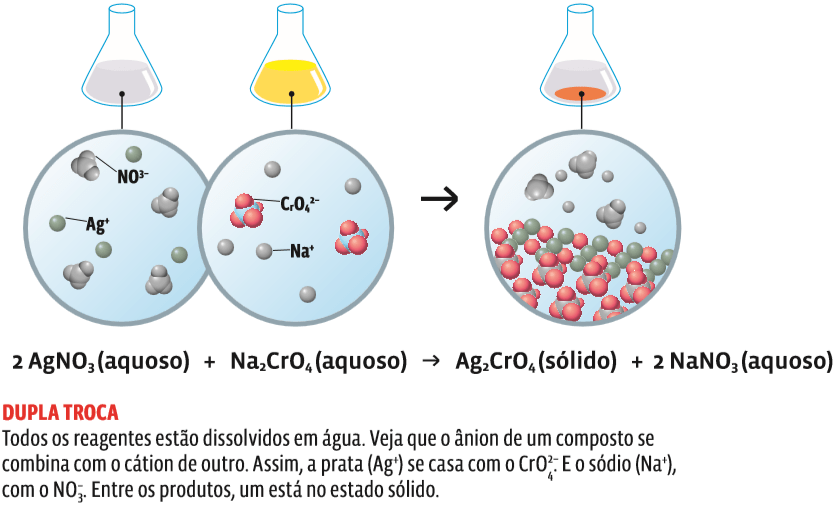

Nas equações químicas, as indicações (g), (l) e (s) que aparecem ao pé de alguns compostos indicam o estado físico da substância – gasoso, líquido ou sólido, respectivamente. A indicação (aq) significa solução aquosa.

O Balanceamento de equações químicas
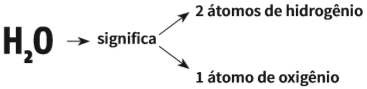
• Quando o coeficiente ou o índice forem iguais a 1, não é necessário escrevê-los:
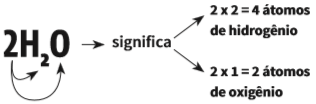
• Quando o coeficiente for maior que 1, ele é multiplicado pelo índice dos elementos para indicar o número de átomos:
Os tipos de reação
• Síntese ou adição
• A + B → C
• Análise ou decomposição
• A → B + C
• Deslocamento ou simples troca
• A + BC → AC + B
• Dupla-troca
• AB + CD → AD + CB




















