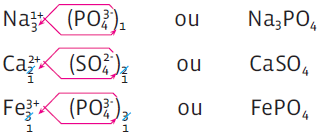Transformações: Substâncias inorgânicas

AZEDINHO a sensação ácida que o paladar percebe no vinagre vem dos íons h+ liberados pelo ácido acético
Ácidos, bases e sais
A natureza de um composto inorgânico depende dos elementos que o formam e das ligações entre eles
Podemos dizer que a química trabalha coma receita de tudo o que existe no mundo material: os tipos de átomos que compõem a matéria e suas possíveis combinações.E, assim como um livro de culinária é dividido entre pratos doces e salgados, a química tem duas partes fundamentais: as funções orgânicas e as inorgânicas. As funções orgânicas envolvem substâncias que têm o carbono (C) como elemento principal.Já as funções inorgânicas são aquelas relativas às substâncias compostas pelos demais elementos e obtidas de recursos minerais. As funções inorgânicas são, por sua vez, classificadas de acordo com suas características e propriedades, em ácidos, bases, sais e óxidos.Aqui tratamos de ácidos, bases e sais. Óxidos serão tratados mais adiante.
Ácidos
São substâncias moleculares. Uma das principais propriedades dos ácidos é que, quando puros, não conduzem eletricidade. Porém, quando estão dissolvidos em água, formam íons – ou seja, sofrem ionização. Isso faz com que a solução passe a conduzir eletricidade. Porque perde átomos de hidrogênio, o restante da molécula do ácido fica com carga negativa. A carga depende do número de hidrogênios ionizados: para um hidrogênio ionizado (H+), a carga adquirida pelo restante do grupo de átomos é (1–), para dois hidrogênios ionizados (2 H+), a carga adquirida pelo restante do grupo de átomos é (2–). E assim por diante.
Ionização: É o processo pelo qual os átomos de hidrogênio (H) interagem com a água e se separam da molécula, transformando-se no cátion H+.
Todos os ácidos formam íons H+. Esse cátion é o responsável pelas propriedades comuns aos ácidos,como o sabor azedo. No estômago, é a acidez do ácido clorídrico (HCl) que garante a digestão dos alimentos. Veja outros exemplos de ionização:
-> O ácido clorídrico (HCl) perde seu único H (que se transforma em cátion H+). O restante da molécula passa a ser o ânion Cl1-
-> O ácido nítrico (HNO3) forma um cátion H+ e um ânion NO31–
-> O ácido sulfúrico (H2SO4) forma dois cátions H+ e o ânion SO42–
-> O ácido fosfórico H3PO4 forma três cátions H+ e o ânion PO43–
Bases
As bases são também conhecidas como hidróxidos,e contêm sempre o ânion hidroxila – um átomo de oxigênio ligado a um de hidrogênio,com carga negativa (OH–). É esse ânion que dá às bases sua característica de adstringência– um sabor que “amarra” a boca, como o caju verde. As bases são compostos iônicos – ou seja,aqueles formados por ligações iônicas –, que se estabelecem entre metais e ametais. Num composto iônico, os átomos não se organizam em moléculas, mas em retículo cristalino.
No estado sólido, as bases puras não conduzem eletricidade, pois os íons estão presos no retículo cristalino. E a eletricidade só seria conduzida se eles estivessem livres para se deslocar. Mas, quando dissolvidas em água, as bases sofrem dissociação iônica ou dissociação eletrolítica, e os íons do composto se separam: de um lado, o ânion OH–,de outro, o cátion que completava o composto.
Indicadores ácido-base
São substâncias usadas para identificar a natureza de uma substância, porque mudam de cor quando combinadas a um ácido ou a uma base.Algumas dessas substâncias são produzidas em laboratório. A fenolftaleína, por exemplo, é incolor quando em contato com um ácido, mas fica vermelha se misturada a uma base. O azul de bromotimol é amarelo num ácido e azul numa base.
Alguns extratos vegetais – de fores ou do repolho-roxo, por exemplo – são chamados indicadores universais, porque mudam de coloração mesmo com uma pequena variação de acidez ou basicidade.

ARCO-ÍRIS Um indicador universal adquire diversas cores quando misturado a ácidos ou bases. Na sequência de tubos de ensaio, a cor muda de vermelho (meio mais ácido) para o verde (meio neutro) e, por fim, o violeta, o meio mais básico
Sais
Os sais podem ser obtidos por uma reação química entre um ácido e uma base numa solução aquosa. Essa é uma reação de neutralização,que tem como produto um sal e água.
É fácil entender por que uma reação de neutralização cria água. Acompanhe o raciocínio:
- Em água, um ácido se dissocia em um ânion e cátions H+;
- Também dissolvida em água, uma base se dissocia em um cátion e ânions OH–;
- Quando essas duas soluções são combinadas, os cátions H+ reagem com os ânions OH– formando moléculas H2O, a água.
- O sal é a união dos ânions provenientes do ácido com os cátions originados da base.
Como toda substância formada por cátions e ânions, os sais são compostos iônicos. Quando são dissolvidos em água, resultam numa solução que conduz eletricidade pelo mecanismo da dissociação iônica.
A diferença entre ionização e dissociação iônica é que, no primeiro processo, os íons são criados a partir de uma molécula neutra.No segundo, os íons já existem no composto iônico. Apenas são separados dele.
O sal de cozinha, NaCl, pode ser obtido da combinação entre um ácido e uma base: o ácido clorídrico (HCl) e a soda cáustica (hidróxido de sódio, NaOH). Veja:
• O composto molecular HCl, em água, se ioniza num cátion H+ e num ânion Cl– ;
• O outro composto iônico NaOH se dissocia em Na+ e OH– ;
• O cátion H+ se combina com o ânion OH– e forma moléculas de água;
• O cátion Na+ se une ao ânion Cl–: é o sal de cozinha, NaCl.
TRANSMISSÃO DE ELETRICIDADE
A condutividade elétrica depende da existência de íons na solução
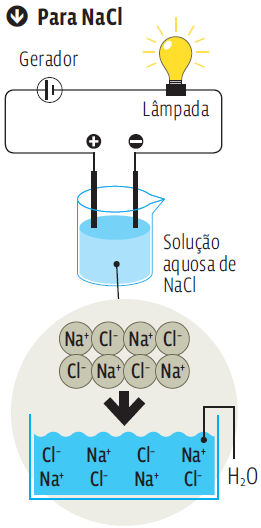
O sal de cozinha (NaCl) é um composto iônico. Sua estrutura é estável e neutra porque os íons estão “casados”. Na água,os íons se soltam e, livres,trafegam de um polo a outro do fio elétrico.
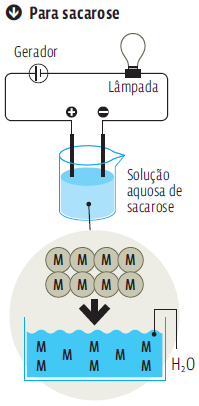
A sacarose é um composto molecular, sem íons.As moléculas (M) se separam,na água, mas mantêm todos os seus átomos. A sacarose não se ioniza. Sem íons na solução,não há eletricidade para trafegar entre os polos.
Soluções eletrolíticas
São soluções que conduzem bem a eletricidade.As substâncias dessas soluções são chamadas eletrólitos. A condutividade elétrica depende da existência de íons. Assim, é fácil entender que uma solução de compostos iônicos conduza bem a eletricidade. Sais e bases são compostos iônicos que dão soluções eletrolíticas. Quanto mais solúvel é uma base ou um sal, maior é sua capacidade de transmitir eletricidade e maior é a condutividade da solução.
Já a condutividade elétrica de compostos moleculares (que não contêm íons) depende da capacidade que as moléculas do composto têm de se ionizar em solução aquosa. É o caso dos ácidos. Todos os ácidos sofrem ionização.Então, todos têm condutividade elétrica quando em solução. Os compostos moleculares que não se ionizam produzem soluções não eletrolíticas.É o caso da sacarose. Veja, no infográfico Transmissão de eletricidade, à esquerda, a diferença entre a condutividade de um composto iônico e a de outra solução, de um composto molecular,que não se ioniza.
Nomenclatura e fórmulas
Nomear um sal e montar sua fórmula não é nada difícil. Mas requer bastante atenção.Vamos passo a passo.
O nome de um sal…
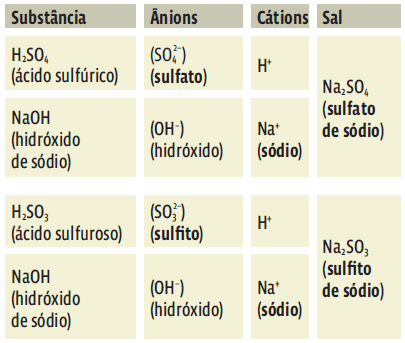
1. …vem dos compostos que o originaram (um ácido e uma base).
2. …começa pelo nome do ânion (vindo do ácido) seguido pelo nome do cátion (vindo da base).
3. O cátion mantém o nome do próprio elemento químico.
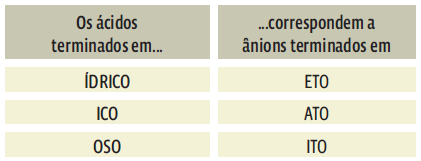
4. O nome do ânion pode terminar em “eto”, “ato” ou “ito”. Isso depende do nome do ácido que deu origem ao ânion.
DO ÁCIDO SAI O NOME DO SAL
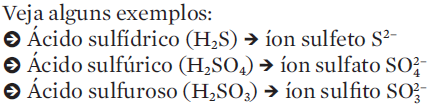
A fórmula de um sal deve trazer a quantidade de átomos envolvidos. Nesse caso, segue-se a regra para a fórmula de qualquer composto iônico: analisa-se a configuração eletrônica de cada um dos elementos químicos do composto e verifica-se a proporção entre eles.
NOMENCLATURA E FÓRMULA
O cloreto de sódio, produzido da combinação de ácido clorídrico com hidróxido de sódio:
• O primeiro nome, cloreto, indica que o Cl– é o ânion retirado de um ácido (clorídrico).
• A segunda parte do nome, “de sódio” Na+, indica que o sódio é o cátion da base.
• Se a fórmula traz antes o cátion e depois o ânion, a fórmula do cloreto de sódio é NaCl.
• NaCl é um cloreto, e não clorato ou clorito, porque o ânion saiu de um ácido cujo nome termina em “ídrico”.