Equilíbrio químico: pH e pOH

Depende do ph Só em solos ácidos nascem hortênsias azuis. Se o solo for alcalino, as fores brotam rosadas
A concentração de íons positivos ou negativos define o caráter ácido ou alcalino de uma solução
Você já viu que moléculas de ácidos, como as do ácido clorídrico (HCl), ou de bases, como as da amônia (NH3), têm a capacidade de interagir com as moléculas de água e formar íons. Quanto maior a capacidade de interação, mais íons são formados e mais forte é o eletrólito.
Agora vamos ver que também as moléculas da água interagem entre si. Nessa interação, uma molécula de água se divide nos íons H+ e OH–, no processo chamado autoionização da água. E esse conceito é importante para entender outro conceito muito usado no dia a dia – o de pH.
O que é pH?
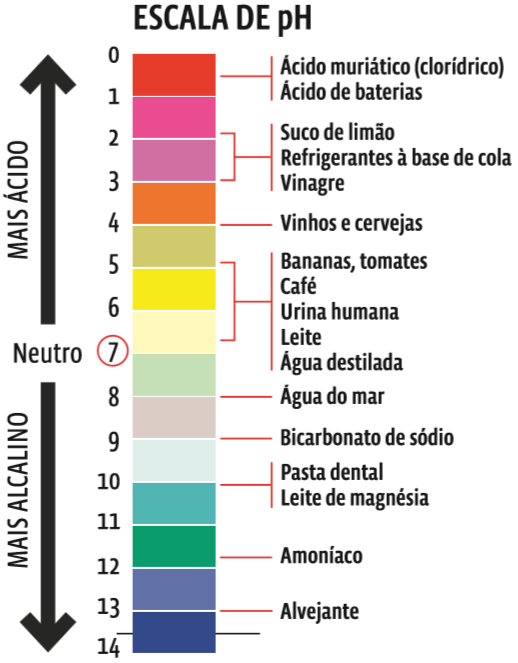
A concentração de íons H+ numa solução define seu grau de acidez. Essa concentração é medida pelo pH, o potencial hidrogeniônico. Quanto mais H+ uma solução tem, maior é sua acidez. Quanto menos H+, mais básica é a solução. O pH é o índice que mede a acidez ou a basicidade de uma solução. O pH segue uma escala de zero a 14, na qual:
-
- 0 ≤ pH < 7 referem-se a soluções ácidas;
- pH = 7, a soluções neutras;
- 7 < pH ≤ 14, a soluções básicas (ou alcalinas).
Produto iônico da água
A água é o solvente universal, aquele em que praticamente todas as substâncias se dissolvem. Por isso, a escala de pH tem como base as concentrações dos íons H+ e OH– na água pura. E daí a importância de entender a autoionização
da água.
A água é neutra porque [H+] = [OH–]. A água é anfótera: dependendo da substância com que reage, ela doa íons H+ ou recebe íons OH–. Isso significa que a água realiza sua própria ionização. A equação química dessa autoionização é:
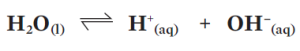
Anfótera: É toda substância que pode assumir caráter ácido ou básico, dependendo da substância com que interage.
O caráter ácido ou básico de uma solução tem relação direta com a concentração de solutos no volume total da solução. E toda reação tem uma constante de equilíbrio – um ponto em que as reações direta e inversa se equilibram e as concentrações se estabilizam. A constante de equilíbrio da água (Kw) é dada pelo produto iônico, a multiplicação das concentrações de íons H+ e OH–: Kw = [H+] . [OH–], em que
- Kw é a constante de equilíbrio da água (a letra w vem de water, água em inglês);
- [H+] é a concentração de íons hidrogênio;
- [OH–] é a concentração de íons hidroxila.
O valor de Kw é conhecido experimentalmente: à temperatura de 25 ºC, Kw = 10–14. Esse é um valor muito pequeno – 0,00000000000001 –, o que indica que a reação de autoionização da água não é fácil de ocorrer. A cada vez que libera um íon H+, a molécula H2O libera também um íon OH–. Portanto, na água pura, [H+] = [OH–].
25 ºC : Considera-se 25 °C a temperatura padrão para todas as medições referentes ao pH. Caso um texto ou uma questão de prova não traga explicitamente o dado, esta é a temperatura que deve ser considerada.
Agora acompanhe o raciocínio:
- Sabe-se que Kw = 10–14
- E sabe-s concentração de 10–7 mol/L significa que, na água pura, a cada 10 milhões de moléculas H2O, apenas uma libera um íon H+ e um OH–;
- A concentração de OH– é igual à concentração de H+;
- Como [H+] define a acidez e [OH–], a basicidade, se [H+] = [OH–], a água é neutra.
A água pura é neutra. Mas a adição de um ácido faz com que [H+] aumente. Como efeito dessa alteração em [H+], o equilíbrio se desloca e [OH–] diminui. Assim, define-se: um meio ácido é aquele que tem [H+] > 10–7 mol/L e [OH–] < 10–7 mol/L.
Por outro lado, com a adição de uma base à água pura, [OH–] cresce. O deslocamento do equilíbrio faz com que [H+] caia. Assim, definimos: um meio básico ou alcalino é aquele que tem [OH–] > 10–7 mol/L e [H+] < 10–7 mol/L.
O truque da escala pH
Até agora, nestas aulas, a natureza ácida ou básica de uma solução foi indicada em termos de concentração. Mas você deve ter reparado que esses valores podem ser muito menores que 1 (por isso são dados como potências negativas de base 10).
Para facilitar a vida dos pesquisadores, o bioquímico sueco Soren Peter Lauritz Sorensen teve uma ótima ideia: dispensar a base 10 e trabalhar apenas com os expoentes – ou seja, com logaritmos. Ele foi o criador dos conceitos de pH (potencial hidrogeniônico) e pOH (potencial hidroxiliônico). A definição:
![]()
Preste atenção na escala de pH: os valores maiores indicam soluções mais básicas. Os menores, soluções mais ácidas.
A notação científica usa as potências de base 10 para indicar grandezas muito altas ou muito pequenas:
- 107 = 10 . 10 . 10 . 10 . 10 . 10 . 10 = 10 000 000
- 10–7 = 1 : 10 : 10 : 10 : 10 : 10 : 10 : 10 = 0,0000001
Mas, nos cálculos com tais valores, o logaritmo é bem mais prático. Logaritmo é a operação matemática que indica o expoente de determinada potência:
![]()
Mantenha em mente:
- Podemos aplicar o logaritmo dos dois lados de uma igualdade, sem alterá-la:
![]()
- Uma das propriedades dos logaritmos diz que:
![]()
Aplicando essas definições e propriedades à expressão matemática do produto iônico, temos:
- Sabemos que Kw = 10–14
Então log Kw = – 14 - Sabemos também que Kw = [H+] . [OH–]
Então log Kw = log [H+] + log [OH–]
→ –14 = log [H+] + log [OH–]
Se, na água pura, [H+] = [OH–], então – 14 = 2 . log [H+]
Onde se conclui que log [H+] = – 14/2 → log [H+] = – 7
(E também log [OH–] = – 7)
Por definição, pH = – log [H+]
Então, para a água pura, pH = pOH = – (– 7) = 7
O pH de soluções aquosas
Mantenha em mente: para qualquer solução aquosa, pH + pOH = 14
Para uma solução ácida, [H+] > 10–7 mol/L e [OH–] < 10–7 mol/L. Então, para uma solução ácida, pH < 7 e pOH > 7
Do mesmo modo, para uma solução básica, [H+] < 10–7 mol/L e [OH–] > 10–7 mol/L Então, para uma solução básica, pH > 7 e pOH < 7
Em gráfico, a variação da acidez do pH e do pOH da água é assim representada:
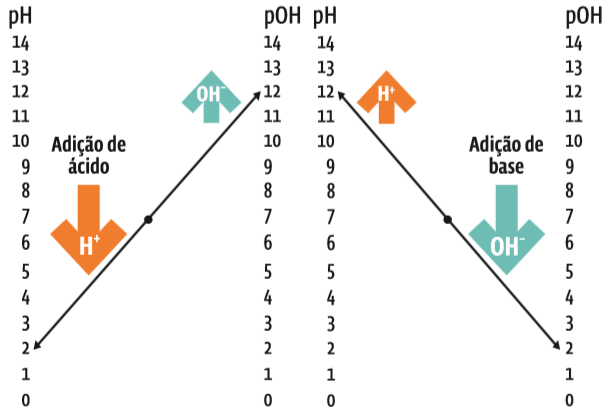
Como a acidez varia. O diagrama da esquerda mostra o que ocorre quando um ácido é adicionado a uma solução aquosa. O da direita, o que acontece quando a substância adicionada é uma base. Em cada um dos gráficos, a escala de pH está à esquerda, e a escala de pOH, à direita. Repare que no centro das escalas pH = pOH = 7. Esses são os valores para a água pura. O primeiro gráfico mostra que, adicionado um ácido, o pH cai e o pOH sobe: a acidez fica maior. No segundo gráfico, acrescentada uma base à solução, o pH sobe e o pOH cai: a solução fica mais alcalina.