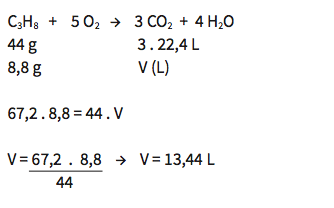Cálculos químicos: Cálculos estequiométricos

RECEITA FURADA. Como um bolo, uma reação química só ocorre com a proporção exata dos ingredientes.
Estequiometria ou cálculo estequiométrico são os cálculos feitos para determinar as quantidades dos reagentes e produtos numa reação química. Do mesmo modo como, para fazer um bolo, precisamos de uma receita que traga a quantidade de farinha, leite, ovos e açúcar, precisamos saber quanto de reagente usamos para certa quantidade de produto. Uma equação em que essas proporções estão corretas é uma equação balanceada. Observe a equação abaixo:
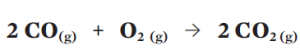
A equação está balanceada, pois a quantidade de átomos nos reagentes é igual ao número deles no produto:
• dois átomos de carbono (C)
• quatro átomos de oxigênio (O2).
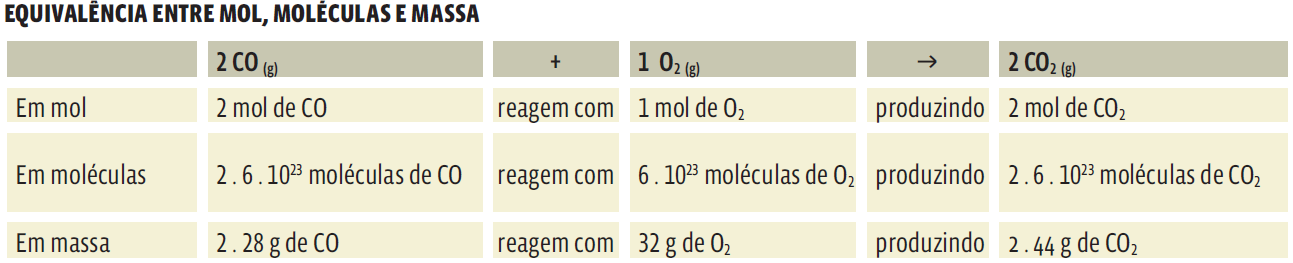
A equação dá a receita da reação: a cada duas moléculas de monóxido de carbono (em 2 CO) que reagem com uma molécula de gás oxigênio (O2) formam-se duas moléculas de dióxido de carbono (2 CO2). Porém, na prática, é impossível trabalhar apenas com uma ou duas moléculas. É aí que entra a grandeza quantidade de matéria, o mol, que vale aproximadamente 6 . 1023 átomos ou moléculas.
Na equação da reação de síntese do dióxido de carbono, mantendo a proporção do número de moléculas, dada pelos coeficientes, podemos dizer que “2 mol de CO reagem com 1 mol de O2 para formar 2 mol de CO2”. Perceba que não se fala mais em moléculas, isoladamente, mas em mol de moléculas. Mas a proporção se mantém. Então concluímos que, numa equação balanceada, os coeficientes dão a proporção, em mol, das substâncias empregadas.
Mol e massa
Além de relacionar mol à quantidade de moléculas ou átomos, podemos também associá-lo à massa de uma substância, por meio da massa molar. Observe:
Quantidade de um gás
Lembrando: todo e qualquer gás tem características
especiais:
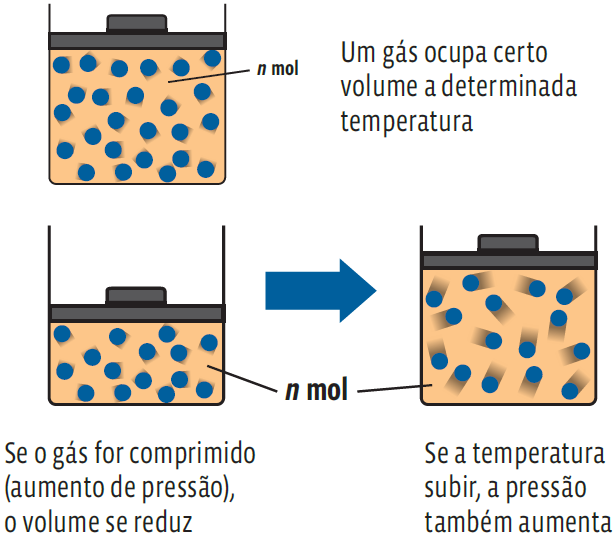
- • ocupa todo o volume disponível e é facilmente comprimido;
- • expande-se com o aumento da temperatura;
- • quanto mais comprimido estiver, maior será a pressão.
Por essas características, a quantidade de um gás qualquer num recipiente varia, dependendo de seu volume, sua temperatura e da pressão à qual está submetido. Esses fatores são as variáveis de estado de um gás. A medida de quantidade de um gás depende, então, de conhecermos essas variáveis:
- • Volume é o espaço ocupado pelas partículas do gás. Depende da temperatura e da pressão do sistema. As unidades de volume mais comuns são litro (L), metro cúbico (m3) e seus submúltiplos.
- • A pressão é resultado do choque das moléculas de um gás com as paredes do recipiente que o contém. A pressão sobe quando a temperatura sobe, ou quando o volume diminui. A unidade mais utilizada em química para medir a pressão de um gás é atmosfera (atm).
- • A temperatura termodinâmica é a medida da energia cinética das partículas do gás. Quanto maior é a temperatura de um gás, mais agitadas ficam as partículas. Se a temperatura sobe, a pressão também sobe,
e maior será a pressão exercida sobre as paredes do recipiente.
A temperatura termodinâmica é geralmente medida em Kelvin (K) e, assim como a escala Celsius (°C), é centígrada (dividida em 100 graus). Zero Kelvin (0 K) corresponde a -273 °C. Para transformar a temperatura de Celsius (°C) para Kelvin (K): T = t + 273, em que t é a temperatura em °C, e T, a temperatura em Kelvin.
Volume molar de um gás
É o volume ocupado por 1 mol de um gás nas condições normais de temperatura e pressão (CNTP): a 0 °C e 1 atm. Nessas condições, qualquer gás ocupa um volume de 22,4 L. Fixado isso, podemos estabelecer a equivalência entre mol e volume. Veja na tabela a seguir essa equivalência na reação entre o monóxido de carbono (CO) e o oxigênio gasoso (O2) que produz dióxido de carbono (CO2).

MASSA MOLAR
A formação da amônia ocorre segundo a reação:
Sabendo que 2,8 g de nitrogênio gasoso reagem com a quantidade adequada de hidrogênio gasoso para formar amônia, calcule a massa do gás hidrogênio consumida nessa reação.
A massa de H2 consumida na formação da amônia a partir de 2,8 g de N2 é de 0,6 g.
QUANTIDADE DE MOL
Uma das substâncias presentes no gás de cozinha é o propano. Durante a queima do propano, o gás oxigênio (O2) é consumido e ocorre a produção de dióxido de carbono (CO2) e vapor d’água. Qual a quantidade, em mol, de oxigênio consumido na queima de 8,8 g de propano (C3H8)?
A queima de 8,8 g de propano (C3H8) exige 1 mol de oxigênio (O2).
Essa é a quantidade das duas substâncias, em massa e mol. Se mantivermos a proporção entre produtos e reagentes, podemos comparar qualquer medida. Por exemplo, o volume de CO2 formado em CNTP. Lembrando: em CNTP, 1 mol de qualquer gás ocupa 22,4 L.
Então, 3 mol de CO2 ocuparão 3 . 22,4 L = 67,2 L. Para descobrir o volume V de CO2 produzido:
O volume de CO2 produzido na queima de 8,8 g propano é de 13,44 L.
Pureza dos reagentes
O grau de pureza é uma medida relacionada a misturas. O grau de pureza de uma substância – esteja ela no estado líquido, sólido ou gasoso – indica a porcentagem dessa substância que efetivamente interessa numa reação, quando essa substância está numa mistura. Grau de pureza é o mesmo que teor.
Para as transformações químicas, o grau de pureza é muito importante. No motor dos automóveis, a queima da gasolina é uma reação entre a gasolina e as moléculas de oxigênio (O2) do ar atmosférico. Porém, o ar não contém só oxigênio. Na verdade, esse gás corresponde a menos de 20% de qualquer volume de ar atmosférico. E 78% desse volume é de nitrogênio (N2). Só que o N2 não entra na queima da gasolina. O que interessa é só o oxigênio. Então, dizemos que o grau de pureza do ar em relação ao oxigênio é de 20%.
PUREZA
Considere a reação:
Qual é a massa de cloreto de ferro II (FeCl2 ) obtida pela reação de 1.100 g de sulfeto de ferro II (FeS), 80% de pureza com excesso de ácido clorídrico (HCl)?
Primeiro, uma observação: a expressão “com excesso”, no enunciado, significa que nem todo HCl vai ser utilizado na reação.
O enunciado fornece a equação já balanceada. Também é informado o grau de pureza de FeS (80%) e a massa que entra na reação (1.100 g). Isso significa que o FeS está misturado a outras substâncias e que, dos 1.100 g dessa mistura, apenas 80% são de FeS. Só essa quantidade reage com o ácido clorídrico (HCl).
Calculando a massa de FeS:
mFeS = 80% de 1.100 g
mFeS = 880 g
Na tabela periódica, consultamos a massa atômica de cada elemento envolvido na reação química e encontramos a massa molar. E, pela regra de três, a massa necessária:
Essa é a massa de FeCl2 que será produzida pela reação entre HCl e 1.100 g de FeS com 80% de pureza.
Rendimento de uma reação
Teoricamente, todas as reações têm 100% de rendimento – ou seja, toda quantidade de reagentes se transforma em produtos. Foi isso o que consideramos em todos os cálculos feitos até aqui, nesta aula. Porém, na prática, as reações sempre apresentam alguma perda. Nem todo reagente é consumido; portanto, nem todo produto é formado.
Quando o rendimento de uma reação é diferente de 100%, a quantidade de produto é menor que a esperada. O rendimento de uma reação depende de vários fatores, que, por sua vez, dependem das condições em que a reação é realizada.
Preste atenção: o cálculo do rendimento de uma reação segue o mesmo raciocínio que fizemos para encontrar o produto da reação de um reagente com grau de pureza inferior a 100%. A diferença é que a medida do grau de pureza é feita antes dos cálculos estequiométricos. Já a medida do rendimento é feita depois dos cálculos estequiométricos.
RENDIMENTO
Queimando-se 30 g de carbono puro, com rendimento de 90%, qual é a massa de dióxido de carbono (CO2) obtida, conforme a equação ![]()
O enunciado informa a equação, e ela já está balanceada. O enunciado também afirma que o rendimento da reação é inferior a 100%. Então, a massa do produto também será menor do que a esperada. Vamos calcular a massa do produto se a reação tivesse 100% de rendimento:
Montamos a regra de três para a quantidade de carbono puro envolvida na reação:
Então, uma reação com 100% de rendimento produziria 110 g de CO2. Mas a reação tem rendimento de 90%. Então é só calcular 90% de110g.Assim, a reação de 30 g de C com 90% de rendimento resulta em apenas 99 g de CO2.