Equilíbrio químico: Deslocamento do equilíbrio
Os fatores que definem o ponto em que não há mais alteração na quantidade de reagentes e de produtos
É um bibelô: um galo azul que se torna rosado quando ameaça chover. Por trás dessa aparente mágica está um fenômeno químico muito simples, que envolve a concentração de substâncias que participam de uma reação. No caso, essas substâncias são um sal, que recobre a peça, e a água existente na forma de vapor, no ar. O sal, quando está seco, é azul. Mas, quando hidratado, muda de cor:

![]()
O aumento na concentração de um dos reagentes (no caso, H2O) provoca o deslocamento do equilíbrio da reação: aumenta a produção de composto rosa, e, por isso, o galinho acusa a proximidade da chuva.
Princípio de Le Chatelier
Entre o fim do século XIX e início do XX, o francês Henry Le Chatelier notou que sistemas em equilíbrio podem ser influenciados por alguma ação externa. O princípio de Le Chatelier diz que:
“Sempre que uma ação externa é exercida sobre um sistema em equilíbrio, o sistema tende a se reajustar, deslocando-se no sentido de minimizar a ação exercida e restabelecer o equilíbrio”.
Trocando em miúdos: uma reação química reversível que esteja em equilíbrio tende a permanecer nesse estado. No caso de falta de equilíbrio, a reação se altera, a fim de alcançá-lo.
O deslocamento do equilíbrio pode ser provocado por mudanças na concentração de produtos ou de reagentes, ou por mudanças na temperatura ou na pressão. Em qualquer uma dessas alterações, o sistema responde imediatamente, aumentando ou diminuindo a velocidade da reação direta ou da inversa. Essa resposta do sistema é o deslocamento de equilíbrio.
Influência da concentração
Considere um sistema fechado em equilíbrio, sob temperatura constante, em que ocorre a seguinte reação reversível:
![]()
A constante de equilíbrio Kc é dada por:
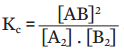 , em que
, em que
1) A2 e B2 são reagentes e
2) AB é o produto.
A adição de A2 (reagente) aumenta o valor do denominador. Então, para manter Kc constante, a concentração do produto AB (no numerador) deve também se elevar. O sistema se encarrega disso e restabelece o equilíbrio, agora com uma concentração maior de AB. Quando isso acontece, dizemos que a reação direta é favorecida e o equilíbrio é deslocado para a direita. É isso o que ocorre com o galinho da chuva. No sentido inverso: se reduzirmos a quantidade de reagente A2, parte do produto AB vai se decompor, produzindo mais A2 e restabelecendo Kc. Isso significa que a reação inversa é favorecida e o equilíbrio é deslocado para a esquerda.
O mesmo se dá quando alteramos a quantidade de produto: para quantidade maior de AB, o valor do numerador sobe e a reação inversa é favorecida, com maior produção dos reagentes A2 e B2. Para quantidade menor de AB e Kc constante, a reação direta é favorecida, com deslocamento para a direita. Em qualquer um dos casos, a concentração de equilíbrio de cada substância difere da concentração original. No entanto, no equilíbrio, Kc se mantém, se a temperatura for constante.
A influência de outros fatores
As condições a que uma reação está submetida envolve outros fatores, como temperatura, pressão e a presença de um catalisador. Veja como um sistema se comporta sob a influência de cada um desses fatores.
– Temperatura: Mantenha em mente: as reações reversíveis envolvem sempre duas reações simultâneas: a reação direta e a inversa. Uma delas é endotérmica, e a outra, exotérmica. Um aumento da temperatura aumenta a energia disponível no sistema. Em resposta, o sistema absorverá mais energia – ou seja, as reações que absorvem energia (endotérmicas) serão aceleradas, ou favorecidas. Um decréscimo de temperatura causa o efeito contrário: para compensar a queda de energia no sistema, a reação exotérmica é favorecida.
A temperatura é o único fator que pode alterar o valor da constante de equilíbrio.
É fácil entender por quê, analisando a influência da temperatura sobre a reação entre nitrogênio (N2) e hidrogênio (H2) que resulta em amônia (NH3). Retomando, a constante de equilíbrio dessa reação é dada por: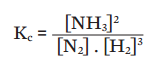
Acompanhe o raciocínio:
1) Aumento da temperatura -> reação endotérmica se acelera -> aumenta a produção de H2 e N2 -> Kc diminui;
2) Queda de temperatura -> reação exotérmica favorecida -> aumenta a produção de NH3 -> Kc sobe.
– A pressão sobre um sistema com substâncias no estado gasoso, se alterada, pode afetar o equilíbrio químico. Mas não tem praticamente nenhum efeito sobre a constante de equilíbrio. De acordo com o princípio de Le Chatelier, qualquer alteração no equilíbrio provoca uma mudança no sistema para minimizar a ação aplicada. Assim, se houver aumento de pressão, o sistema responde tentando diminuí-la: favorece a reação de menor volume. Se houver diminuição, o sistema tenta aumentá-la, favorecendo a reação de maior volume. Mas a constante permanece a mesma.
– Catalisadores jamais deslocam o equilíbrio – ou seja, não alteram o estado final de equilíbrio. Apenas aumentam a velocidade da reação direta e da inversa. A única consequência da aplicação de um catalisador sobre uma reação é fazer com que o sistema alcance o ponto de equilíbrio mais rapidamente.
EQUILÍBRIO E CONCENTRAÇÃO
Veja o que acontece quando na reação de síntese da amônia (NH3) adicionamos certa quantidade de N2 a um sistema inicialmente em equilíbrio e sob temperatura constante. A reação reversível é:
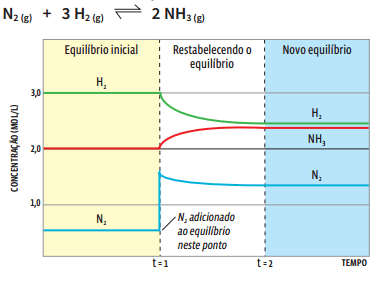
A faixa amarela mostra a concentração inicial de equilíbrio dos reagentes e do produto:
1) [H2] = 3,0 mol/L
2) [NH3] = 2,0 mol/L
3) [N2] = 0,5 mol/L
No momento t1 acrescenta-se N2 no recipiente. A concentração de N2 se eleva de 0,5 para 1,5 mol/L. Imediatamente há alteração na concentração das outras duas substâncias: a de H2 cai e a de NH3 sobe. Essa alteração provoca, também, mudança na concentração de N2 , que volta a cair um pouco. Se a concentração de NH3 sobe, então a reação direta foi favorecida: houve deslocamento do equilíbrio para a direita. Tudo em busca do novo ponto de equilíbrio. Depois de algum tempo, a partir de t2, as reações direta e inversa voltam a se equilibrar, agora com as novas concentrações:
1) [H2] ≈ 2,4 mol/L
2) [NH3] ≈ 2,3 mol/L
3) [N2] ≈ 1,3 mol/L
Podemos confirmar que a alteração nas concentrações não afetou o Kc , substituindo os valores conhecidos na equação de equilíbrio. Para o equilíbrio (Kc1), com as concentrações iniciais:
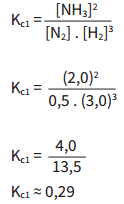
A constante de equilíbrio com as novas concentrações (Kc2), depois do acréscimo de N2:
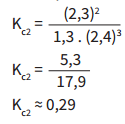
Confirmado: as concentrações se alteraram, mas o equilíbrio permaneceu o mesmo.
EQUILÍBRIO E TEMPERATURA
Na reação de H2 com N2, que resulta em amônia (NH3)

– Se a temperatura subir, a reação endotérmica será favorecida: cresce a produção de H2 e N2.
– Se a temperatura cair, a reação exotérmica será favorecida: aumenta a produção de NH3.
EQUILÍBRIO E PRESSÃO
Considerando, mais uma vez, a reação de produção da amônia, temos:

Nessa reação, 3 mol de hidrogênio reagem com 1 mol de nitrogênio para formar 2 mol de amônia. Em termos de volume molar (V), os gases reagentes ocupam 4 V, e o gás resultante ocupa apenas 2 V. Se a pressão aumentar, o sistema terá o equilíbrio deslocado no sentido do menor volume, à direita – a reação direta será favorecida, produzindo mais do produto que ocupa volume menor. Se, ao contrário, a pressão sobre o sistema for reduzida, a reação se deslocará para a esquerda. A reação inversa será favorecida e crescerá a produção de reagentes, que ocupam mais volume. De novo, a alteração da pressão é minimizada. Em todos os casos, Kc permanece constante.
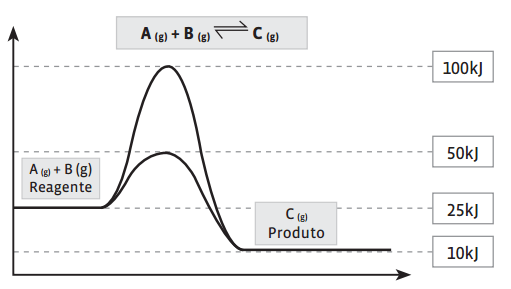
Tudo num único diagrama
Um diagrama de entalpia fornece todas as informações necessárias sobre o comportamento de uma reação reversível. Acompanhe no diagrama abaixo, considerando que o sistema está em equilíbrio: