Equilíbrio químico: Reações reversíveis

Em círculo vicioso
Algumas reações se revertem, transformando em reagente o que era produto, e vice-versa

ESPUMANTE – Quando uma garrafa de refrigerante ou de champanhe é aberta, uma reação química é defagrada e forma gás carbônico. O gás escapa, criando a espuma
Existem dois tipos de reação: as reversíveis e as irreversíveis. Uma reação irreversível é aquela que não pode ser feita no sentido inverso. Por exemplo, a combustão: na queima de uma folha de papel ou de gasolina, a substância original deixa de existir e é impossível recuperar o papel ou o combustível do produto da reação, CO2 e cinzas. Uma reação reversível é aquela em que os reagentes se transformam em produtos e esses produtos voltam a se transformar nas substâncias originais, os reagentes. Um exemplo de reação reversível é a formação de gás carbônico quando se abre uma garrafa de refrigerante. O que define se uma reação é reversível ou irreversível tem a ver com o equilíbrio químico, ou equilíbrio dinâmico.
Numa reação reversível, os elementos A e B reagem para formar C e D. Essa é a chamada reação direta:
![]()
No sentido contrário, os produtos C e D reagem para formar novamente A e B, numa reação inversa:
![]()
Representamos essa situação de reversibilidade assim:
![]()
Situação de equilíbrio
Considere uma reação reversível que ocorre num sistema fechado (um recipiente que não permita que nenhuma substância saia nem entre). No início da reação existirão apenas moléculas dos reagentes colidindo entre si até obter energia suficiente para formar os produtos, na reação direta. Desde o momento em que surgem moléculas dos produtos no sistema, elas também entram em colisão, até obter energia para formar novamente os reagentes, na reação inversa. Ocorrem, então, duas reações simultaneamente.
Mantenha em mente: a concentração dos reagentes influencia na velocidade da reação. No início da reação direta, quando temos apenas moléculas dos reagentes, a velocidade de formação dos produtos é a máxima. Isso porque existem muitas moléculas para colidir e se transformar em produtos. À medida que os reagentes se transformam em produtos, a quantidade de reagentes cai e, por consequência, cai também a velocidade da reação direta.
Por outro lado, a velocidade da reação inversa é nula no início da reação, pois não há moléculas de produtos. Mas, à medida que os produtos se formam, sua concentração aumenta, e também a velocidade da reação.
Em algum momento desse processo de vaivém, a velocidade das reações direta e inversa se iguala. As reações continuam acontecendo, nos dois sentidos, mas a concentração de produtos e reagentes não mais se altera. Essa é a situação de equilíbrio químico ou equilíbrio dinâmico. É como se fosse um jogo de cabo de guerra, em que as forças aplicadas de cada um dos lados são iguais, mas opostas, se anulando.
Num gráfico, a variação na concentração das substâncias de uma reação qualquer fica assim:
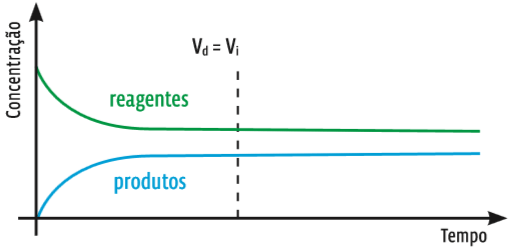
Tanto de um, Tanto de outro Veja no eixo da concentração: no início, há bem mais reagentes do que produtos. Mas, a partir de certo momento, a velocidade da reação direta é a mesma que a da reação inversa (Vd = Vi). A partir de então, as concentrações de reagentes e produtos se mantêm constantes.
Para essa mesma reação genérica, o gráfico das velocidades das reações direta e inversa é:
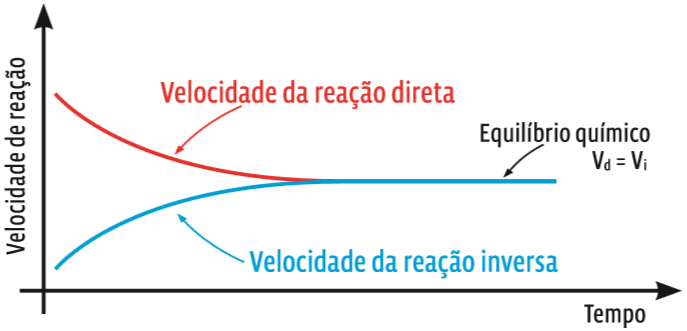
Juntinhas Repare como a velocidade das reações varia no decorrer do tempo. No início, quando há apenas reagentes, a reação direta ocorre em alta velocidade. Nesse mesmo momento, a reação inversa ainda é muito lenta, pois praticamente não há produtos para reagir. Mas, à medida que a reação ocorre, a velocidade da reação direta se reduz e a da reação inversa cresce. Em certo momento, as velocidades se igualam (Vd = Vi). É o equilíbrio químico.
Se os dois gráficos forem comparados, o momento em que a concentração de cada substância se estabiliza coincide com o momento em que a velocidade das duas reações se iguala.
![]()
A reação de decomposição do N2O4 (g) em NO2 (g) é reversível: ![]()
O gás N2O4 é incolor; o gás NO2 tem cor castanho-avermelhada. Num sistema isolado, à medida que as moléculas de N2O4 se colidem e reagem, a cor vai se alterando pelo aumento gradual na concentração de NO2. Em determinado momento, a cor não se altera mais, pois o sistema entra em equilíbrio.
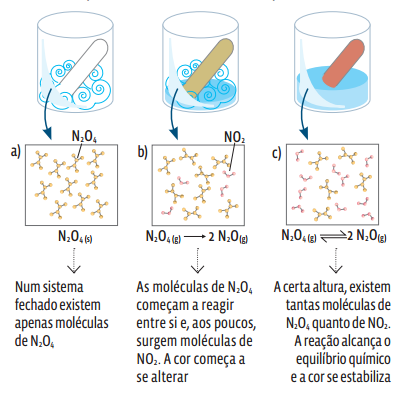
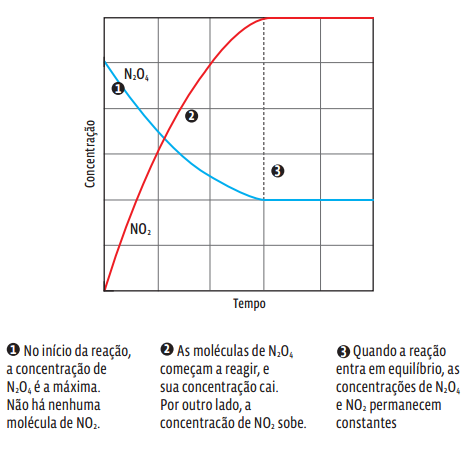
Num gráfico, a concentração de cada uma das duas substâncias nessa reação reversível é assim representada:
QUEBRA DO EQUILÍBRIO
 Ao abrir uma garrafa de refrigerante você provoca várias reações.
Ao abrir uma garrafa de refrigerante você provoca várias reações.
A reação mais notável é a de formação do ácido carbônico (H2CO3), que se decompõe em água (H2O) e gás carbônico (CO2). Com a garrafa fechada, e em temperatura constante, essa reação reversível permanece em equilíbrio: o H2CO3 se forma e, ao mesmo tempo, se decompõe. Quando a garrafa é aberta, a pressão no interior cai – o que altera a velocidade das duas reações. O líquido borbulha.
Constante de equilíbrio
Na década de 1860, os cientistas noruegueses Cato Guldberg e Peter Waage verificaram que, para qualquer reação reversível, o equilíbrio químico apresenta uma regularidade. Eles criaram a lei de ação das massas, que define uma constante de equilíbrio (Kc) em termos de concentração. A lei diz que, em uma reação reversível, mantida constante a temperatura, a razão entre as concentrações de produtos e reagentes elevadas a seus coeficientes estequiométricos é constante.

Lembre-se de que os colchetes são indicação de concentração. Por exemplo, [A] é a concentração da substância A.
Considere a seguinte reação reversível:
![]()
1) A e B reagem para formar C e D;
2) Ao mesmo tempo, C e D reagem para formar A e B;
3) As letras a, b, c e d são os coeficientes estequiométricos da reação (o número que indica a quantidade de mol de cada substância participante da reação).
A constante de equilíbrio para a reação ![]() é dada pela expressão:
é dada pela expressão:
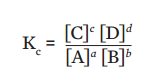
O valor da constante de equilíbrio é específico para cada reação e depende da temperatura. No entanto, não depende da concentração inicial de reagentes. Veja na tabela abaixo os resultados de diversos experimentos com a reação reversível entre N2O4 e NO2, em diferentes concentrações iniciais, todos realizados à temperatura de 100 °C:
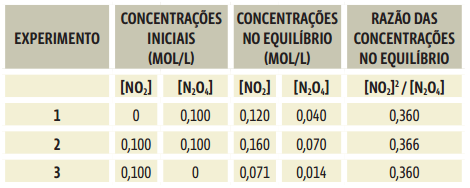
Repare na coluna Concentrações iniciais que:
1) No experimento 1, o recipiente contém 0,100 mol/L de N2O4 e nada de NO2;
2) No experimento 2, o recipiente contém 0,100 mol/L de NO2 e 0,100 mol/L de N2O4;
3) No experimento 3, o recipiente contém somente NO2, na concentração de 100 mol/L.
Após determinado tempo, a coloração do gás estabilizou-se dentro de cada recipiente, indicando que o sistema entrou em equilíbrio. A coluna Concentrações no equilíbrio mostra quanto de NO2 e de N2O4 existia no momento em que o equilíbrio foi alcançado. Repare que as concentrações no equilíbrio diferem de um experimento a outro, dependendo da concentração inicial de reagentes.
Agora observe a coluna Razão de concentrações no equilíbrio. Veja que os valores são muito próximos, praticamente iguais em todos os experimentos. Esse valor que se mantém é a constante de equilíbrio da reação![]()
Se 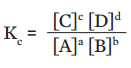
Temos que, para ![]()
Repare que, na razão que define Kc, o numerador traz os produtos, e o denominador, os reagentes. Então, quanto mais produtos a reação formar, maior será sua Kc.
Se o valor da constante de equilíbrio foi maior que 1, a reação direta é favorecida – ou seja, ocorre mais espontaneamente. Se o valor da constante for menor que 1, então a reação mais espontânea é a reação inversa.
Para reforçar:
1) Kc > 1 -> reação direta é favorecida;
2) Kc < 1 -> reação inversa é favorecida.
Se a reação ![]() apresenta Kc = 0,36, que é menor que 1, então a reação favorecida é a inversa, de NO2 para N2O4.
apresenta Kc = 0,36, que é menor que 1, então a reação favorecida é a inversa, de NO2 para N2O4.

No cálculo de uma constante de equilíbrio, consideram-se as concentrações em mol/L sempre da situação de equilíbrio.

REAÇÃO DIRETA
Veja o que ocorre na reação de formação do SO3 a partir da reação entre SO2 e O2, a uma temperatura de 25°C:
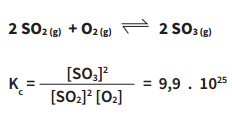
O resultado, maior que 1, indica que a reação favorecida é a direta, de SO2 para SO3.






















