A Estrutura da Matéria: Como cai na prova
1. (UFRN 2013) O efeito fotoelétrico está presente no cotidiano, por exemplo, no mecanismo que permite o funcionamento das portas dos shoppings e nos sistemas de iluminação pública, por meio dos quais as lâmpadas acendem e apagam. Esse efeito acontece porque, nas células fotoelétricas, os metais emitem elétrons quando são iluminados em determinadas condições. O potássio e o sódio são usados na produção de determinadas células fotoelétricas pela relativa facilidade de seus átomos emitirem elétrons quando ganham energia. Segundo sua posição na Tabela Periódica, o uso desses metais está relacionado com
a) o baixo valor do potencial de ionização dos átomos desses metais.
b) o alto valor da afinidade eletrônica dos átomos desses metais.
c) o alto valor da eletronegatividade dos átomos desses metais.
d) o alto valor do potencial de ionização dos átomos desses metais.
2. (Unesp 2016) leia o texto e examine a tabela para responder a questão a seguir.
O ano de 2015 foi eleito como o Ano Internacional da Luz, devido à importância da luz para o Universo e para a humanidade. A iluminação artificial, que garantiu a iluminação noturna, impactou diretamente a qualidade de vida do homem e o desenvolvimento da civilização. A geração de luz em uma lâmpada incandescente se deve ao aquecimento de seu filamento de tungstênio provocado pela passagem de corrente elétrica, envolvendo temperaturas ao redor de 3.000 °C.
Algumas informações e propriedades do isótopo estável do tungstênio estão apresentadas na tabela.
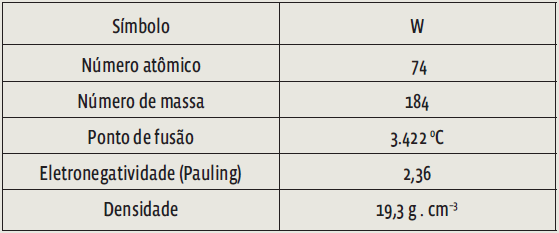
A partir das informações contidas na tabela, é correto afirmar que o átomo neutro de tungstênio possui
a) 73 elétrons.
b) 2 elétrons na camada de valência.
c) 111 nêutrons.
d) 184 prótons.
e) 74 nêutrons.
3. (CFTMG 2016) Observe os dois gráficos de variação da temperatura ao longo do tempo, disponibilizados abaixo:
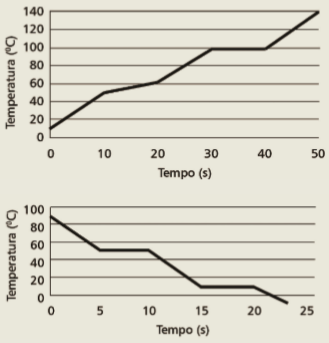
Um dos gráficos corresponde ao perfil de uma substância pura e o outro, ao perfil de uma mistura.
O período de tempo que a substância pura permanece totalmente líquida e a temperatura de ebulição da mistura, respectivamente, são
a) 5s e 10 °C.
b) 5s e 100 °C.
c) 10s e 50 °C.
d) 10s e 60 °C.
4. (Unesp 2015) Alguns historiadores da Ciência atribuem ao filósofo pré-socrático Empédocles a Teoria dos Quatro Elementos. Segundo essa teoria, a constituição de tudo o que existe no mundo e sua transformação se dariam a partir de quatro elementos básicos: fogo, ar, água e terra. Hoje, a química tem outra definição para elemento: o conjunto de átomos que possuem o mesmo número atômico. Portanto, definir a água como elemento está quimicamente incorreto, porque trata-se de:
a) uma mistura de três elementos.
b) uma substância simples com dois elementos.
c) uma substância composta com três elementos.
d) uma mistura de dois elementos.
e) uma substância composta com dois elementos.
RESPOSTAS
1. O potencial de ionização é a energia necessária para retirar um elétron de um átomo, em uma substância que está em estado gasoso. Essa medida indica a capacidade de perda de elétrons de cada elemento químico. Os metais alcalinos pertencem ao grupo I – lítio (Li), sódio (Na), potássio (K), rubídio (Rb), césio (Cs) e frâncio (Fr). São elementos que estão na primeira coluna da tabela periódica (afora o hidrogênio, que é um elemento especial). Os átomos desse grupo necessitam de pouca energia para perder elétrons da camada de valência (da última camada). Lembrando, ainda: um átomo que perde seus elétrons de valência transforma-se num cátion; e o potencial de ionização cresce na proporção inversa ao raio do átomo – quanto maior o raio, menor será o potencial de ionização. Resposta: A
2. A questão pede que você domine conceitos básicos da química. Analisando cada uma das alternativas:
a) Incorreta. A tabela traz dados do isótopo estável do tungstênio – o elemento em seu estado neutro. Isso significa que o número de elétrons é igual ao número de prótons. Você deve se lembrar que o número de prótons equivale ao número atômico (Z). Segundo a tabela, o número atômico do tungstênio é 74. Portanto, o número de elétrons é também 74.
b) Correta. Basta fazer a distribuição eletrônica dos 74 elétrons, no diagrama de Linus Pauling:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d4.
c) Incorreta. O número de massa é a soma do número atômico com o número de nêutrons (A = Z + N). Sabemos que Z = 74. Portanto, N = 184 – 74 → N = 110
d) Incorreta. Já vimos que o número de massa (184) é a soma do número de prótons com o de nêutrons.
e) Incorreta. Como já verificamos na análise da alternativa c, o número de nêutrons é 110.
Resposta: B
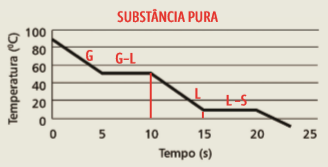
3. Primeiro, você deve identificar o gráfico que se refere a mudanças de estado de uma substância pura. É o segundo gráfico, pois só substâncias puras permanecem com a temperatura constante durante as mudanças de estado. Repare que esse gráfico mostra o comportamento da substância conforme a temperatura desce. Portanto, o primeiro patamar de temperatura constante refere-se à passagem de gás para líquido (condensação), e o segundo, à passagem do estado líquido para o sólido (solidificação). O período em que a substância permanece totalmente líquida está no intervalo de 10 s a 15 s – ou seja, a substância permanece no estado líquido durante 5 s.
A segunda parte da questão pede a temperatura de ebulição da mistura – informação que deve ser obtida da leitura do primeiro gráfico. Para uma mistura, a temperatura pode variar nas mudanças de estado, pois cada substância tem seu próprio ponto de fusão e de ebulição. Temperatura de ebulição é a temperatura na qual ocorre tanto a ebulição (no aquecimento) quanto a condensação (ou liquefação), no resfriamento. Desta vez, o gráfico mostra a reação da mistura ao aquecimento. Identificando as mudanças de estado, temos:
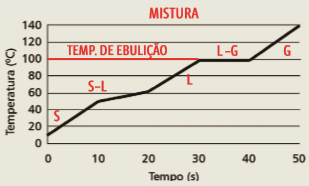
Pelo gráfico, podemos concluir que na mistura o ponto de ebulição – quando a substância passa do estado líquido para o gasoso – é de 100 °C.
Resposta: B
4. Você deve se lembrar da fórmula química da água: H2O. Portanto, a água não é uma substância simples, porque é formada de dois elementos químicos, hidrogênio e oxigênio, representada por uma única fórmula. Também não é uma mistura. Misturas são formadas por dois ou mais compostos químicos, cada um deles com sua fórmula. Por exemplo, a água salgada: água (H2O) mais cloreto de sódio (NaCl). Essas fórmulas não se alteram porque os dois compostos foram misturados.
Resposta: E
RESUMO
Estrutura da matéria
SUBSTÂNCIA E MISTURA: Durante a mudança de estado, a temperatura de uma substância não se altera. Já numa mistura, a temperatura se altera nas mudanças de estado. As misturas cuja temperatura varia no ponto de ebulição são eutéticas. Aquelas nas quais a temperatura varia no ponto de fusão são azeotrópicas. Misturas homogêneas têm apenas uma fase; heterogêneas são aquelas que têm mais de uma fase.
MODELOS ATÔMICOS: Modelo de Dalton: o átomo é uma esfera maciça e indivisível. Modelo de Thomson: o átomo é como um pudim de passas, com os elétrons incrustados no núcleo. Modelo Rutherford-Böhr: um núcleo com elétrons circulando em volta.
PRÓTONS, NÊUTRONS e ELÉTRONS: O número de prótons é o número atômico (Z). A soma do número atômico com o número de nêutrons resulta no número de massa (A). Isótopos: átomos de mesmo Z, mas com diferente número de nêutrons, e, portanto, diferentes A. A relação entre o número de prótons e o de elétrons define as propriedades químicas dos átomos. Íons são átomos que ganham ou perdem elétrons. Cátions perdem elétrons, ânions ganham.
NÍVEIS E SUBNÍVEIS DE ENERGIA: Os elétrons se distribuem por sete camadas, chamadas níveis de energia. Essas camadas podem ser nomeadas por letras, e cada uma delas comporta um número máximo de elétrons:
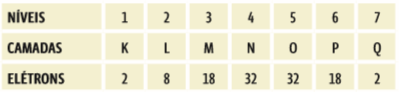
SUBNÍVEIS DE ENERGIA: Cada nível de energia é dividido em subníveis. Existem quatro subníveis: s, p, d e f. E cada um desses subníveis também comporta um número máximo de elétrons:

O diagrama de Pauling define a ordem em que os elétrons se distribuem pelos níveis e seus respectivos subníveis: 1s2 2s2 2p6 3s2 3p6 4s2 3d10… A camada de valência é a última camada a conter elétrons, independentemente do subnível em que esses elétrons se encontram.
LIGAÇÕES ATÔMICAS: Teoria do octeto: os átomos se ligam preenchendo camada de valência com oito elétrons. Ligações iônicas unem cátions a ânions. Quanto mais eletronegativo for um átomo, maior será sua força de atração sobre elétrons de outro átomo. Nas ligações covalentes, os átomos de eletronegatividade próxima compartilham elétrons. Nas ligações covalentes dativas, os elétrons compartilhados pertencem originalmente a apenas um dos átomos.









