Estrutura da matéria: Tabela periódica
Individualidade atômica Cada elemento químico é um átomo com características específicas
Cada coisa em seu lugar
Quem sabe ler a tabela periódica obtém dela informações sobre diversas propriedades dos elementos
A ciência conhece 118 elementos químicos. Mas 26 deles não existem na natureza. São átomos extremamente instáveis e, por isso, só aparecem quando sintetizados em laboratório.
A descoberta dos elementos químicos foi feita paulatinamente. Até o fim do século XVII, conheciam-se apenas 14 deles; um século depois, eram 33. Com o advento da ciência moderna, no século XIX, 83 elementos foram identificados. Com uma lista desse tamanho, tornava-se cada vez mais necessário um sistema de organização que permitisse trabalhar com os elementos. Houve várias tentativas (veja o quadro “Saiba mais”, na pág. ao lado). A classificação que prevaleceu foi a proposta pelo russo Dimitri Mendeleev.
A tabela de Mendeleev
Em 1869, Mendeleev juntou as tentativas anteriores e dispôs os elementos conhecidos num quadro com doze linhas (na horizontal) e oito colunas (na vertical). Na horizontal, os elementos obedeciam à ordem crescente de massa (dada pela soma do número de prótons e o de nêutrons). Na vertical, apresentavam características semelhantes. Mendeleev atribuía as imperfeições da tabela a erros no cálculo das massas. Ele tinha tanta certeza disso que deixou alguns espaços vagos na tabela, para o encaixe de elementos ainda não descobertos. Essas vagas foram, depois, realmente preenchidas.
Mendeleev não acertou em tudo. Para ele, por exemplo, as propriedades químicas de um elemento eram dadas pela massa, como imaginavam também seus contemporâneos. Hoje, sabe-se que o que caracteriza um elemento é o número de prótons, ou seja, o número atômico (Z). Por isso, a tabela periódica usada hoje é construída em função de Z. Seja como for, a ordem dos elementos não foi muito alterada, pois, na maior parte das vezes, a massa cresce conforme o número de prótons. Foi por isso que Mendeleev acertou na previsão dos elementos químicos desconhecidos à sua época.
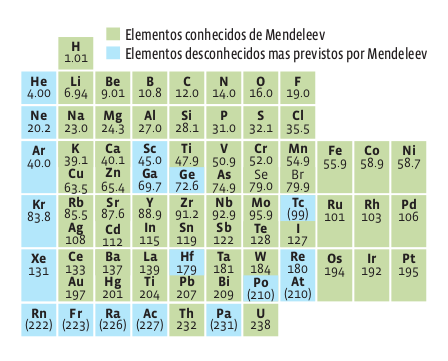
A disposição proposta por Mendeleev agrupa os elementos de acordo com características importantes dos átomos. Acompanhe, a seguir, a identificação dessas características.
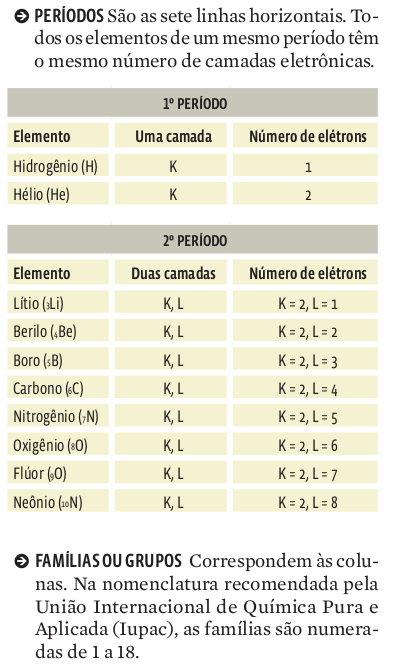
Os elementos de uma mesma família apresentam configurações eletrônicas semelhantes, o que lhes confere, também, propriedades químicas semelhantes. Por exemplo: todos os elementos da família do berilo (Be) têm distribuição eletrônica que apresenta como característica ns 2 , em que
• n é o período em que se encontra o último subnível de energia. Esse número cresce conforme descemos pela coluna de uma mesma família;
• Mas a configuração eletrônica de todos os elementos da família do Be termina com dois elétrons sempre no subnível s;
• Isso signifca que o berílio (Be) e todos os elementos abaixo dele têm dois elétrons na camada de valência. E esses elétrons estão sempre no subnível s de energia. Veja:
Os elementos de uma mesma família apresentam confgurações eletrônicas semelhantes, o que lhes confere, também, propriedades químicas semelhantes. Por exemplo: todos os elementos da família do berilo (Be) têm distribuição eletrônica que apresenta como característica ns 2 , em que
• n é o período em que se encontra o último subnível de energia. Esse número cresce conforme descemos pela coluna de uma mesma família;
• Mas a configuração eletrônica de todos os elementos da família do Be termina com dois elétrons sempre no subnível s;
• Isso signifca que o berílio (Be) e todos os elementos abaixo dele têm dois elétrons na camada de valência. E esses elétrons estão sempre no subnível s de energia. Veja:

Propriedades periódicas e aperiódicas
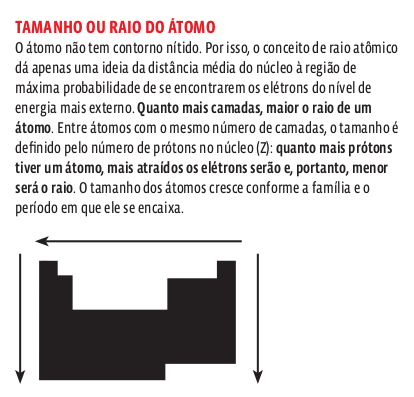
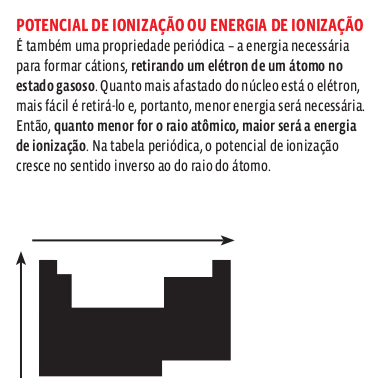
As propriedades periódicas são aquelas cujos valores crescem ou decrescem em função do número atômico e se repetem a cada grupo de elementos. São propriedades periódicas o raio atômico, o potencial de ionização e a afnidade eletrônica.
As propriedades aperiódicas também dependem do número atômico, mas não se repetem regularmente na tabela. Um exemplo de propriedade aperiódica é a massa atômica, pois ela sempre cresce com o aumento do número atômico, mas não se repete nunca entre todos os elementos.
Uma classificação científica se baseia em diferenças e semelhanças. Foi isso o que os químicos começaram a procurar na relação de elementos, principalmente a partir do século XIX.
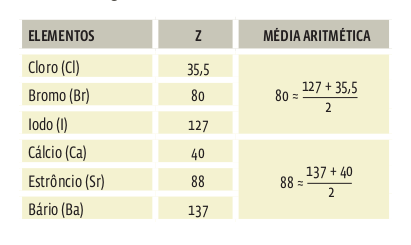
Em 1817, o químico alemão Johann Wolfgang Döbereiner percebeu que, em alguns grupos de três elementos que apresentavam propriedades semelhantes, a massa atômica (MA) de um deles sempre era a média aritmética da massa atômica dos outros dois. Döbereiner organizou, então, grupos de três elementos na chamada lei das tríades. As tríades logo caíram, pois abrangiam um número pequeno de elementos. Algumas tríades de Döbereiner:
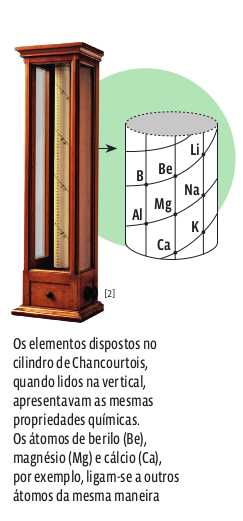
Em 1863, o geólogo francês Alexandre-Émile de Chancourtois tomou por base um cilindro e traçou uma curva helicoidal (em forma de hélice) que dividia o cilindro em 16 fatias verticais. Os elementos de propriedades semelhantes caíam todos na mesma fatia. No mesmo ano, o químico inglês Alexander Reina Newlands colocou as massas atômicas em ordem crescente e, com isso, organizou grupos de sete elementos. Ele reparou que as propriedades se repetiam no oitavo elemento – ou seja, ele encontrou uma periodicidade, que foi chamada de lei das oitavas. Essa classificação apresentava erros porque os valores das massas atômicas estavam errados.
TABELA PERIÓDICA
A ordem criada por Mendeleev permite que se identifiquem as principais características de cada elemento