Transformações: Cinética química

Uma questão de ritmo
Para uma reação ocorrer, as partículas dos reagentes devem atingir a energia mínima para quebrar as ligações
As reações químicas ocorrem em diferentes velocidades. Algumas, como o acender de um fósforo, são instantâneas. Outras são mais lentas, como o metabolismo dos alimentos no organismo humano ou o apodrecimento de um alimento mal conservado. Há, ainda, aquelas que levam dezenas ou centenas de milhões de anos para ocorrer, como a formação da atmosfera terrestre ou do petróleo.
A velocidade das reações depende de uma série de fatores. E a área da química que estuda essa velocidade e os fatores que nelas influem chama-se cinética química.
Rapidez das reações
Em física, na mecânica, a velocidade é a variação do espaço percorrido por um móvel em determinado intervalo de tempo. Na química, o conceito de velocidade é um pouco diferente: é a rapidez com que uma reação se realiza, sempre levando em conta a quantidade de reagentes consumidos ou a de produtos formados. Essa quantidade pode ser expressa em massa, volume ou em mol. Pode, também, ser dada em termos de concentração. A regra geral é que, em toda reação, a quantidade de reagentes diminui, enquanto a quantidade dos produtos aumenta. Para a reação R → P, a concentração de R cai, enquanto a concentração de P sobe. Essa mudança nas concentrações não mantém o mesmo ritmo durante toda a reação.
No início, a quantidade de R cai rapidamente e a de P sobe rapidamente. Com o passar do tempo, a variação segue mais lenta. Como regra geral, à medida que os reagentes são consumidos, a velocidade da reação diminui. Veja:
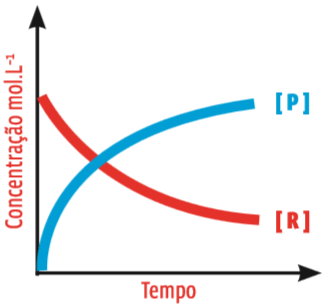
As curvas A concentração do produto P (em azul) cresce à medida que o reagente R (em vermelho) é consumido. As curvas aproximam-se gradualmente da paralela com o eixo do tempo. Isso indica que a transformação de R em P é cada vez mais lenta.
O gráfico dá muitas informações importantes:
• A quantidade de substância P no início da reação é zero. Então essa substância é o produto, e R, o reagente;
• No início da reação, a concentração de P e a de R variam muito rapidamente;
• Depois, a concentração de ambas as substâncias varia num ritmo mais lento.
Teoria das colisões
Você sabe: uma reação química ocorre quando as ligações entre átomos ou íons dos reagentes se quebram e se rearranjam, formando novas substâncias, os produtos. Mas como e quando isso ocorre?
Como sempre fazem quando querem entender um fenômeno impossível de ser visto diretamente, os químicos criaram um modelo para explicar o que ocorre durante uma reação química, com base no que é observado em experimentos. Esse modelo é a teoria das colisões. De acordo com essa tese, para que uma reação ocorra, as partículas dos reagentes devem colidir entre si numa determinada velocidade e com certa frequência.
Numa substância, a cada segundo ocorrem bilhões de colisões entre átomos, íons ou moléculas. Mas poucas dessas colisões iniciam uma reação – ou seja, ocorre um número muito menor de colisões efetivas. Isso depende de dois fatores: a energia e a orientação do choque.
A energia do choque é cinética – ou seja, aquela relacionada à velocidade das moléculas. É fácil de entender: se um carro colidir com um poste a 100 km/h, o estrago será maior do que se o choque se desse a 50 km/h. Assim também acontece com as moléculas e os íons: para que as ligações se quebrem, é preciso que a colisão tenha a energia cinética adequada. Quanto maior a energia, maior a velocidade da reação.
Quanto maior o número de colisões entre as partículas, maior a possibilidade de conseguir a energia necessária para quebrar as ligações dos reagentes. Mas essa efetividade depende, ainda, de uma orientação adequada.
A teoria das colisões propõe também uma explicação para o fato de que nem todas as colisões desencadeiam uma reação. Acompanhe:
- Moléculas que se movem lentamente têm baixa energia cinética;
- Ao colidirem, as eletrosferas dessas moléculas não se interpenetram. Ao contrário, se repelem, por causa da carga dos elétrons. Assim, não há quebra de ligações nem formação de novas substâncias.
ORIENTAÇÃO: É importante a posição dos átomos na hora do choque. Uma orientação adequada é aquela que põe em contato direto os átomos que vão estabelecer as novas ligações.
Porém, para essa mesma reação, se a temperatura dos reagentes for elevada, a situação muda. Acompanhe:
- Quanto mais alta a temperatura, maior é a agitação das moléculas;
- Com velocidade maior, os átomos trombam com maior energia cinética;
- Isso faz com que as eletrosferas se confundam, criando um complexo ativado – um estado de transição entre as substâncias originais (reagentes) e a formação de novas substâncias (produtos). Veja:
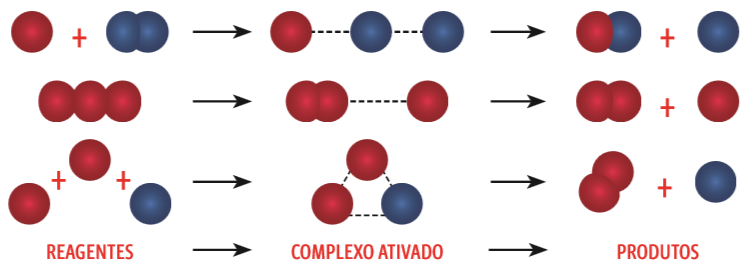
Colisões efetivas
Para que a reação NO3 (g) + CO (g) → NO2 (g) + CO2 (g) ocorra, três condições têm de ser satisfeitas:
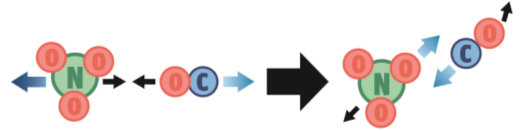
1. Orientação correta. A colisão pode ter energia suficiente, mas essa orientação não é adequada porque o choque se dará entre os átomos de oxigênio, que não reagem entre si. Neste caso, não ocorre a reação.
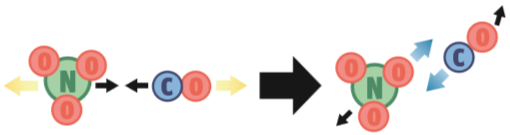
2. Energia suficiente. Nesta segunda possibilidade, a orientação das partículas dos reagentes é adequada: o átomo C quebrará as ligações de NO3 para roubar um átomo O. Mas a colisão ocorre numa velocidade muito baixa. Não há energia suficiente para provocar uma reação.
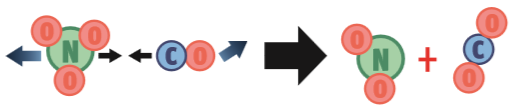
3. Tudo certo. A velocidade com que as partículas se chocam fornece energia suficiente para a quebra das ligações. E a orientação das partículas dos reagentes é adequada: o átomo C baterá num átomo O.
No complexo ativado, as ligações estão enfraquecidas, prestes a se romper. Quando o sistema atinge a energia mínima necessária para rompê-las, a reação se completa com a formação de novas substâncias. Romper essa barreira energética significa atingir a energia de ativação (Ea) – aquela necessária para desencadear a reação.
Energia de ativação: Podemos então dizer que a energia de ativação é a energia mínima necessária para que uma reação seja desencadeada.
A energia de ativação é sempre maior que a energia original dos reagentes. Essa variação pode ser representada em gráfico.
Para a reação CO + NO 2 → CO 2 + NO, o gráfico de energia seria este:
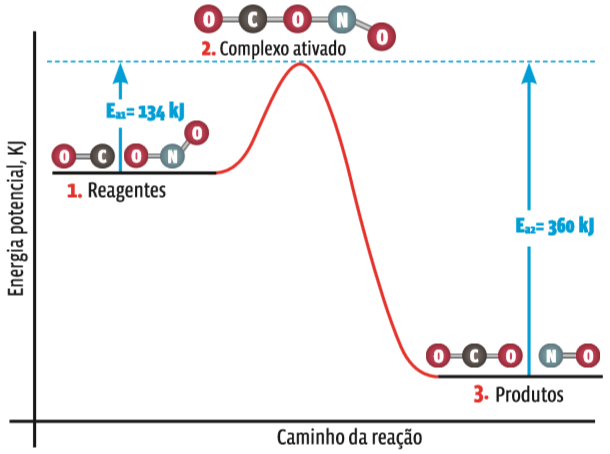
Variação de energia
1. As moléculas dos dois reagentes viajam a uma velocidade que dá ao conjunto a energia cinética adequada
2. Se no choque a energia superar a barreira da energia de ativação, os átomos, por um instante, confundirão seus elétrons, enfraquecendo as ligações
3. Reorganizados os átomos em novas substâncias, a energia do sistema volta a cair
Entre duas reações que ocorram nas mesmas condições, a que tem menor energia de ativação (Ea) se dará com maior rapidez, pois mais facilmente as moléculas atingirão a energia de ativação e, por consequência, o estado de complexo ativado. Compare as reações mostradas nos dois gráficos abaixo:
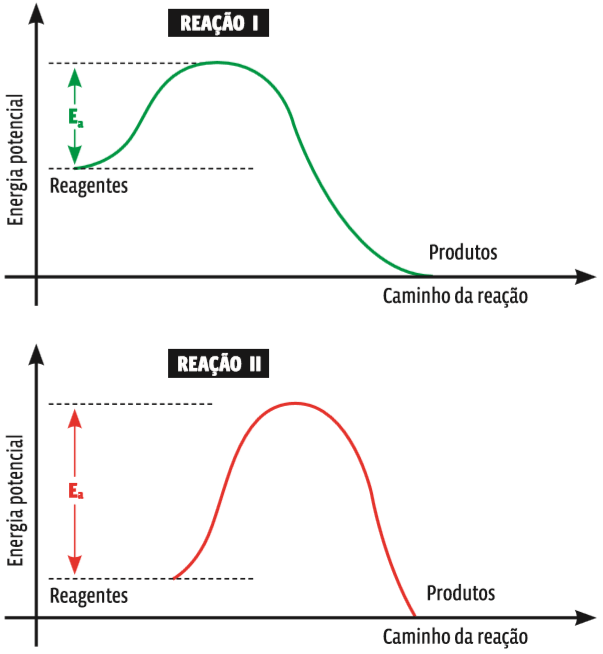
Energia e velocidade Pelo pico da curva em cada um dos gráficos percebe-se que a energia de ativação da reação II é mais alta que a energia de ativação da reação I. Isso significa que a barreira energética que os reagentes da reação II têm de ultrapassar para reagir entre si é mais alta. Então, a reação II é mais lenta do que a reação I.
CATALISADORES
São substâncias químicas que aumentam a velocidade de uma reação sem participar diretamente dela, ou seja, sem serem consumidas. Os catalisadores alteram o mecanismo de uma reação, baixando a barreira da energia de ativação. Ao final da reação, os catalisadores podem ser recuperados e reaproveitados. Veja no gráfico abaixo como uma reação tem a velocidade alterada com o emprego de um catalisador:
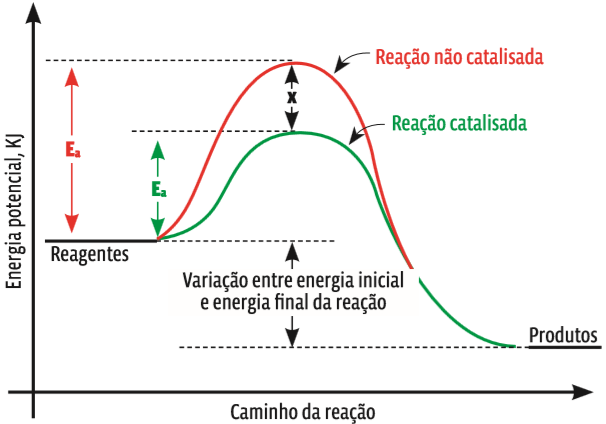
Mãozinha a Miga Repare que as duas reações começam no mesmo patamar de energia. E veja a diferença de altura das duas curvas. Na reação não catalisada, os reagentes têm de alcançar uma energia de ativação muito mais alta do que na reação catalisada. Então, a velocidade da reação catalisada é maior.
Gráfico – O que isso tem a ver com matemática?
Leitura de gráficos é conhecimento muito pedido nas provas de matemática, física e química. Você deve saber como ler um gráfico como este. A cada valor do eixo x (Caminho da reação) corresponde um valor do eixo y (Energia potencial).
Os catalisadores não provocam uma reação, apenas a aceleram. E cada reação tem um catalisador específico. Nos seres vivos, as enzimas, produzidas pelas células, fazem o papel de catalisadores nas reações do metabolismo – as transformações que as substâncias sofrem no interior das células. Sem essas reações, as células não podem crescer nem se reproduzir nem exercer suas funções específicas. As enzimas aceleram o metabolismo, e sua carência leva a desordens metabólicas que causam doenças no fígado, nos rins ou nos músculos, por exemplo.
Outros fatores
Outras condições podem acelerar a velocidade de uma reação, como a eletricidade e a luz. No meio natural, a reação entre os gases hidrogênio e oxigênio para formar água é muito lenta, pode levar anos. Mas, quando se passa uma corrente elétrica pelo sistema, a reação ocorre instantaneamente. Assim, a eletricidade influi na velocidade da reação. Mas não pode ser considerada um catalisador, porque não é uma substância química. É uma forma de energia que ajuda o sistema reacional a atingir a energia de ativação. O mesmo ocorre com a luz.
O que influi na velocidade
• ESTADOS FÍSICOS DOS REAGENTES A velocidade das partículas de uma substância depende do estado físico em que ela se encontra. A velocidade é baixa no estado sólido, cresce no estado líquido e atinge o máximo no estado gasoso. Quanto maior é a velocidade das partículas, maior é a energia do sistema e mais veloz é a reação, então as reações com reagente gasosos costumam ser as mais rápidas.
Estado físico
Quando misturadas, as substâncias cloreto de sódio (NaCl) e nitrato de prata (AgNO 3 ) fazem uma reação de dupla troca que resulta em dois produtos: nitrato de sódio (NaNO 3 ) e o precipitado de cloreto de prata (AgCl). Mas esse precipitado só aparece quando a reação se dá em uma solução. Separados pela água e livres, os íons Ag + e Cl – colidem com boa velocidade, reagem e formam o precipitado.
Já quando os reagentes estão no estado sólido, os íons estão presos no retículo cristalino do sal – a reação não ocorre.
• SUPERFÍCIE DE CONTATO Experimentalmente se verifica que a velocidade de uma reação é tanto maior quanto maior for a superfície de contato entre as substâncias reagentes. Nesse sentido, sistemas gasosos e líquidos oferecem condições mais favoráveis que os sistemas sólidos. Explica-se: uma reação acontece entre os átomos de uma substância. No estado sólido, só os átomos da superfície entrarão em contato com os da substância com que deveriam reagir. Assim, quanto mais pulverizado for o sólido, maior será a superfície de contato entre os átomos e maior a velocidade da reação.
SUPERFÍCIE DE CONTATO
Um comprimido de vitamina C colocado em água provoca efervescência. Inteiro, somente os átomos da superfície entrarão em contato com a água, e a reação vai ocorrendo lentamente à medida que os átomos vão paulatinamente sendo expostos. Se o comprimido for quebrado em vários pedacinhos, a reação ocorrerá mais rapidamente, pois mais átomos serão expostos à água ao mesmo tempo. Daí, mais colisões ocorrem num mesmo intervalo de tempo, e maior é a velocidade da reação.
• TEMPERATURA Quanto mais alta a temperatura, maior a velocidade da reação. Isso porque a temperatura tem relação direta com a velocidade das partículas e, portanto, com a energia cinética do sistema. Quanto maior a temperatura, maior é a energia cinética das moléculas e, portanto, maior será a probabilidade de um choque efetivo – aquele que ocorre com a energia suficiente e na orientação adequada.
TEMPERATURA
A influência da temperatura na velocidade das reações tem várias aplicações no dia a dia. Por exemplo, o cozimento de feijão (ou qualquer outro alimento) em panela de pressão. A pressão mais alta eleva a temperatura no interior da panela, e o feijão cozinha mais rápido. No sentido inverso, a baixa temperatura no interior de uma geladeira retarda o processo de apodrecimento dos alimentos.
• CONCENTRAÇÃO É a quantidade de moléculas existentes em determinado volume de reagentes. Quanto maior é a concentração de um reagente, mais moléculas dessa substância existem em determinado volume. Como a velocidade de uma reação depende do número de colisões efetivas, então quanto mais próximas estiverem as moléculas, maiores serão as chances de ocorrer colisões efetivas. Por isso, um aumento na concentração dos reagentes eleva a velocidade da reação.
CONCENTRAÇÃO
Qualquer combustão depende da reação do combustível com o oxigênio. Uma palha de aço posta sobre uma chama queima-se relativamente rápido, porque o ar contém certa concentração de oxigênio. Mas a combustão será muito mais veloz se for provocada num recipiente fechado, que contenha apenas oxigênio. A concentração de oxigênio no ar é menor do que num ambiente de oxigênio puro, é claro.




















