As Transformações: Como cai na prova
1. (IFSP 2016) O ácido maleico, C2H2(COOH)2, pode ser totalmente queimado, segundo a equação:
C2H2(COOH)2 + O2 → CO2 + H2O
Se essa equação for corretamente balanceada, os coeficientes são os seguintes:
a) 1, 4, 3, 2.
b) 1, 4, 2, 3.
c) 1, 2, 4, 3.
d) 1, 3, 4, 2.
e) 2, 3, 4, 1.
2. (UFSM 2015) Os sais estão presentes nos shows pirotécnicos. Os fogos de artifício utilizam sais pulverizados de diferentes íons metálicos como, por exemplo, o sódio (cor amarela) e o potássio (cor violeta), misturados com material explosivo, como a pólvora. Quando a pólvora queima, elétrons dos metais presentes sofrem excitação eletrônica, liberando a energia na forma de luz.
Sobre a cinética da reação, é correto afirmar:
a) Quanto maior a superfície de contato entre os reagentes, mais rápida é a reação; assim, quanto mais dividido o reagente sólido, mais a reação será acelerada.
b) A queima dos fogos de artifício é facilitada pelo uso de sais pulverizados, pois estes diminuem a energia de ativação da reação.
c) A temperatura gerada na queima de fogos de artifício reduz a frequência dos choques entre as partículas de reagentes, tornando a reação mais rápida.
d) A reação é mais rápida, pois, ao se utilizar o sal pulverizado, a frequência das colisões é menor, favorecendo, assim, a reação.
e) A pólvora age como um catalisador, diminuindo a energia de ativação total da reação química.
3. (UFSM 2015) Os portugueses tiveram grande influência em nossa cultura e hábitos alimentares. Foram eles que trouxeram o pão, produzido à base de cereais, como o trigo, a aveia e a cevada.
Fonte: Universidade Federal de Brasília.
A contribuição dos portugueses. ATAN/DAB/SPS/MS
Para fazer a massa de pães e bolos aumentar de volume, é comum o uso de algumas substâncias químicas:
I. O bromato de potássio era comumente utilizado no preparo do pão francês; no entanto, nos dias atuais, essa substância está proibida, mesmo em pequenas quantidades. O bromato de potássio era utilizado para proporcionar um aumento de volume no produto final devido à formação de O2 conforme a reação
![]()
II. A adição de fermentos, como o bicarbonato de sódio no preparo de bolos, é utilizada desde a antiguidade até os dias atuais, e resulta no crescimento da massa e na maciez do bolo. O bicarbonato de sódio, devido à liberação de gás carbônico, é utilizado para expandir a massa e deixá-la fofa, conforme a reação
![]()
Sobre essas reações, é correto afirmar que:
a) a primeira é de síntese e a segunda é de deslocamento.
b) a primeira é de decomposição e a segunda é de deslocamento.
c) a primeira é de síntese e a segunda é de decomposição.
d) as duas são de decomposição.
e) as duas são de síntese, pois formam O2 e CO2 respectivamente.
4. (Udesc 2015) Um estudante de química obteve uma solução indicadora ácido-base, triturando no liquidificador algumas folhas de repolho roxo com água. Em seguida, ele dividiu a solução obtida em três tubos de ensaio (A, B e C) e no primeiro tubo adicionou uma pequena quantidade de vinagre (solução de ácido acético); no segundo, alguns cristais de soda cáustica (NaOH), e no terceiro, alguns cristais de sal para churrasco (NaCl), obtendo o resultado conforme mostra o quadro:
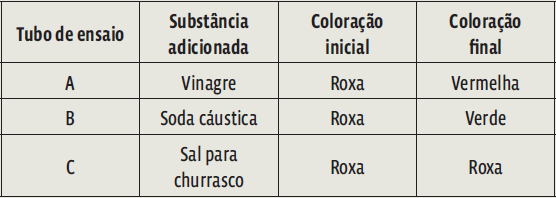
Se o estudante realizar outro experimento adicionando no tubo A, KOH, no B, HNO3, e no C, KNO3, contendo a solução inicial extraída do repolho roxo, a coloração final, respectivamente será:
a) roxa, verde, roxa.
b) roxa, vermelha, verde.
c) verde, roxa, vermelha.
d) vermelha, verde, roxa.
e) verde, vermelha, roxa.
RESPOSTAS
1. Para balancear a reação, o número de átomos do lado esquerdo deve ser igual ao número do lado direito. Para isso, definimos os coeficientes estequiométricos. Na reação C2H2(COOH)2 + O2 → CO2 + H2O , temos:

• Para igualar os quatro C do lado esquerdo, ficamos com 4 CO2.
• Para os quatro H, ficamos com 2 H2O.
• Repare que, depois dos passos acima, ficamos com dez átomos de oxigênio – oito em 4 CO2 e dois em 2 H2O. Voltamos ao lado esquerdo e acrescentamos um coefciente em O2 – 3 O2. A equação balanceada é C2H2(COOH)2 + 3 O2 → 4 CO2 + 2 H2O
Resposta: D
2. Você deve se lembrar dos fatores que influem na velocidade de uma reação:
• Quanto maior a superfície de contato, maior a velocidade, porque o número de choques entre os reagentes aumenta e, assim, maior é a probabilidade de um choque com energia suficiente e na orientação adequada para promover a reação;
• Catalisadores: são substâncias que aumentam a velocidade de uma reação sem que sejam consumidas. Os catalisadores diminuem a energia de ativação.
• Quanto maior a temperatura, maior será a velocidade, pois o aumento da temperatura aumenta a energia cinética (a agitação) das partículas. Com isso, novamente, maior é a probabilidade de choques que promovam a reação.
Analisando as alternativas:
a) Correta. Quanto maior a superfície de contato (triturado, pulverizado, dividido) entre os reagentes, maior contato entre os reagentes, possibilitando o choque. Com o aumento de choques, a possibilidade de choques efetivos (geometria adequada e energia suficiente) aumenta e, por isso, mais rápida é a reação.
b) Incorreta. A pulverização aumenta a área de contato. O que reduziria a energia de ativação seria um catalisador.
c) Incorreta. Temperaturas mais altas aumentam agitação das partículas, o que faz com que ocorram mais choques efetivos.
d) Incorreta. Qualquer fator que reduza a frequência das colisões reduz também a velocidade da reação. A pulverização, como já vimos, aumenta a frequência, acelerando a reação.
e) Incorreta. A pólvora não age como catalisador, pois é consumida durante o processo de queima.
Resposta: A
3. Lembrando: as reações são classificadas como:
• reação de síntese ou adição: duas ou mais substâncias resultam num único produto;
• reação de análise ou decomposição: um único composto se separa em substâncias mais simples;
• reação de deslocamento ou simples troca: uma substância simples reage com uma substância composta, produzindo outros dois compostos;
• reação de dupla troca: íons de cargas iguais trocam de posição, produzindo outros dois compostos.
Analisando as duas reações, vemos que um único composto se decompõe em outros, mais simples, pela simples ação do calor (indicado pelo símbolo Δ).
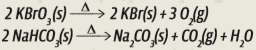
Temos, então, duas reações de decomposição
Resposta: D
4. Um indicador ácido-base é uma solução que mostra se uma substância é um ácido ou uma base. Se não mudar de cor, a substância adicionada não é nem ácido, nem base (pode ser um sal). Você deve conhecer a função química de cada composto e as regras básicas de nomenclatura e fórmula.
• Vinagre é uma solução de ácido acético – portanto, um ácido. Segundo o enunciado, a cor do indicador mudou para vermelho. Então essa é a cor para ácidos;
• Soda cáustica é hidróxido de sódio. Hidróxidos (que contêm o ânion OH–) são sempre bases. Se a cor mudou para verde, essa é a cor esperada para bases em geral.
• E o sal de cozinha (NaCl), o nome já indica: sal. Como não é nem ácido nem base, é natural que o indicador não mude de cor.
Agora basta identificar sua natureza. E, para isso, você deve conhecer as regras básicas da construção de fórmulas:
• KOH: o radical (OH–) indica que se trata de uma base: a cor mudará para verde.
• HNO3: o cátion H+ indica que se trata de um ácido: a cor muda para vermelho
• KNO3: repare que este composto é a união do cátion K+, da base KOH, com o ânion NO3– , do ácido HNO3, acima. A ligação entre dois íons liberados da combinação de ácido com base resulta num sal. No indicador ácido-base, a cor não se altera.
Resposta: E
RESUMO
As transformações
ÁCIDOS, BASES E SAIS: Ácidos são substâncias moleculares. Dissolvidos em água, sofrem ionização e liberam cátions H+. Bases (hidróxidos) são compostos iônicos que contêm ânions OH–. Em solução aquosa, as bases sofrem dissociação iônica. Sais são compostos iônicos que também sofrem dissociação iônica quando dissolvidos em água. Podem ser obtidos da reação entre um ácido e uma base, no processo de neutralização.

REAÇÕES QUÍMICAS: Ocorrem quando as ligações químicas de uma substância são quebradas e os átomos se combinam em novas substâncias. Tipos de reações:
• Síntese: A + B → C
• Decomposição: A → B + C (pirólise, eletrólise)
• Simples troca: A + BC → AC + B
• Dupla troca: AB + CD → AD + CB
ÓXIDOS: São compostos binários em que o oxigênio é o elemento mais eletronegativo. Óxidos iônicos: o oxigênio se liga a um metal. A maioria reage com a água e forma uma base. Óxidos moleculares: o oxigênio se une a um ametal, em ligação covalente. Muitos são gases. Podem reagir com a água e formar ácidos. Óxidos moleculares, como CO2, SO2 e NO2, se transformam em ácido na atmosfera e contribuem para aumentar a acidez da chuva, de mares e solos.
VELOCIDADE DAS REAÇÕES: É a rapidez com que uma reação ocorre, em razão dos produtos formados ou dos reagentes consumidos. Em geral, a quantidade de reagentes diminui enquanto a de produtos aumenta. Para ocorrer uma reação, é preciso que as partículas se choquem com velocidade suficientemente grande para gerar energia acima da energia de ativação, e na orientação adequada (os átomos que vão se combinar devem entrar em contato direto). Complexo ativado: estado intermediário entre substâncias iniciais e finais de uma reação.Catalisadores: substâncias químicas que reduzem a energia de ativação e, assim, aceleram as reações.
BALANCEAMENTO DE EQUAÇÃO: Numa reação química a quantidade de matéria não se altera. A quantidade de átomos ou moléculas dos reagentes deve ser igual à soma das quantidades dos produtos. Balancear a equação é encontrar essa proporção, definindo o número de compostos que entram na reação. Para isso, usamos os coeficientes. Para balancear a equação H2 + O2 → H2O precisamos acrescentar o coeficiente 2 diante do H2 e do produto H2O: 2 H2 + O2 → 2 H2O.









