Calorimetria

EM BUSCA DO EQUILÍBRIO – Cubos de gelo num copo de refrigerante à temperatura ambiente derretem. Em compensação, a bebida gela
As medidas do calor
Alto verão. Você chega em casa, morto de sede. Mas alguém deixou de colocaras garrafas de refrigerante na geladeira. Você, então, põe alguns cubos de gelo no copo. E, rapidamente, a bebida está fresca e o gelo, derretido. Esse gesto é tão natural que você provavelmente jamais parou para pensar: por que o gelo baixa a temperatura da bebida? Que tipo de fenômeno é esse?
Quando dois corpos em temperaturas distintas são colocados em contato, ocorre uma transferência de calor do corpo de maior temperatura inicial para o de menor temperatura. Essa transferência de calor só se interrompe quando os corpos atingem o equilíbrio térmico, ou seja, quando as temperaturas finais dos dois corpos forem iguais.
A forma como dois corpos chegam ao equilíbrio térmico depende de diversas variáveis, como a temperatura inicial, a natureza e a massa de cada um dos corpos envolvidos. Sobre essas variáveis, os físicos construíram três conceitos importantes: calor específico, calor sensível e calor latente.
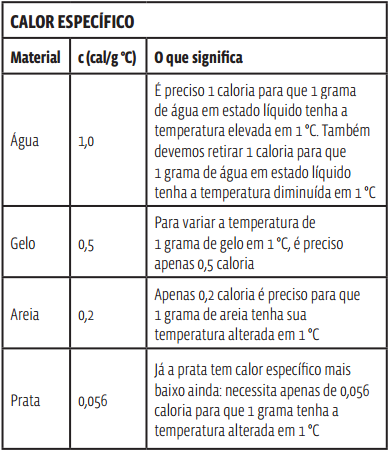
 CALOR ESPECÍFICO
CALOR ESPECÍFICO
Calor específico, representado por c, é a quantidade de energia necessária para que 1 grama de determinado material apresente uma variação de temperatura de 1 °C. A unidade de medida mais usual para calor específico é cal/g °C. Mas no sistema internacional de unidades (S.I.) essa medida é dada em joule por quilograma e kelvin (J/kg K).
O calor específico de um corpo é uma grandeza física própria do material que constitui esse corpo – e independe das dimensões ou da massa do corpo. Assim, um bloco de 1 quilo de prata e outro bloco de 100 quilos de prata apresentam o mesmo calor específico. Veja na tabela abaixo o calor específico de alguns materiais.
CALOR SENSÍVEL
É a quantidade de energia envolvida no processo de alteração da temperatura de um corpo, sem que o corpo mude de estado físico.
A quantidade de calor sensível recebida ou cedida por um corpo de massa m e que apresenta uma variação de temperatura Δθ é dada pela equação fundamental da calorimetria:
![]()
→ Q é o símbolo para quantidade de energia (neste caso, calor sensível);
→ m é a massa do corpo;
→ c é o calor específico;
→ Δθ é o símbolo de variação da temperatura.
![]()
Calor específico (c) é um conceito diferente de capacidade térmica ou capacidade calorífica (C). O calor específico indica a quantidade de energia para que determinado material fique 1°C mais quente. Sua unidade é caloria por grama graus Celsius (cal/g °C) ou joule por quilograma kelvin (J/kg K). Quanto maior é o calor específico de um material, mais energia ele exige para mudar de temperatura.
Já a capacidade térmica indica quanto um corpo perde ou absorve calor, em função da variação de temperatura. A capacidade térmica depende da massa do corpo. A unidade, no S.I., é joule/kelvin (J/K) ou cal/°C. Quanto maior for a capacidade térmica de um corpo, mais lentamente ele se aquece ou resfria.
Corpos de massas diferentes e de mesma substância têm calor específico igual, mas diferentes capacidades térmicas. Corpos de massa e de substâncias diferentes podem apresentar a mesma capacidade térmica.
O recheio de uma empada é mais quente que a massa que o recobre porque a capacidade térmica do recheio é menor que a da massa – ou seja, recebendo a mesma quantidade de calor, o recheio tem uma variação maior de temperatura. E, quanto mais recheio houver, mais você queimará a língua. As expressões matemáticas que definem a capacidade térmica de um corpo são recobre porque a capacidade térmica do recheio é menor que a da massa – ou seja, recebendo a mesma quantidade de calor, o recheio tem uma variação maior de temperatura. E, quanto mais recheio houver, mais você queimará a língua.
As expressões matemáticas que definem a capacidade térmica de um corpo são
→ C = Q /Δθ, em que C é a capacidade térmica; Q é a quantidade de calor (energia) recebida ou perdida; Δθ é a variação de temperatura sofrida pelo corpo.
→ C = m . c , em que C é a capacidade térmica; m é a massa do corpo; c é o calor específico do material de que o corpo é constituído.
Sempre que um corpo tem a temperatura aumentada, dizemos que ele recebeu certa quantidade de energia, chamada de calor sensível, do meio externo. Analogamente, quando um corpo apresenta uma diminuição de temperatura, dizemos que ele perdeu certa quantidade de energia, ou calor sensível, para o meio externo. Assim, Q pode assumir valores positivos ou negativos. Em linguagem matemática:

CALOR LATENTE
É a energia envolvida no processo de mudança do estado físico (ou fase) de uma substância, e seu valor depende tanto da massa quanto da mudança de estado físico em questão. A quantidade de energia Q necessária para que um corpo de massa m sofra determinada mudança de fase é calculada pela expressão:
![]()
→ Q é a quantidade de energia (ou seja, quantidade de calor latente);
→ m é a massa do corpo;
→ L é o calor latente da mudança de fase em questão, medido em cal/g.
A quantidade de calor latente (Q) recebida ou perdida por um corpo não provoca mudança de temperatura. É responsável apenas pela alteração do estado de agregação de suas partículas, ou seja, pela mudança de seu estado físico.
O comportamento de um corpo que é aquecido no estado sólido, passa pelo estado líquido e atinge o estado gasoso pode ser descrito num gráfico que mostre o que ocorre com sua temperatura em função da quantidade de calor trocada entre o corpo e o meio externo. É a chamada curva de aquecimento.
Ao lado você vê dois gráficos. O primeiro mostra uma curva de aquecimento genérica. Nele, as temperaturas de fusão e ebulição se referem a uma substância qualquer. O segundo, logo abaixo, é a curva de aquecimento de um cubo de gelo.
TROCAS DE CALOR
Quando dois corpos são postos em contato dentro de um recipiente termicamente isolado, o corpo mais quente cede calor para o corpo mais frio, até que o equilíbrio térmico seja atingido.
Termicamente isolado: Um recipiente que oferece isolamento térmico é aquele que impede que seu conteúdo troque calor com o meio
externo. Uma geladeira de isopor e uma garrafa térmica são recipientes termicamente isolados. Mas, como o isolamento nunca é perfeito, depois de algum tempo o conteúdo acaba cedendo energia térmica ao ambiente, ou ganhando dele.
![]()
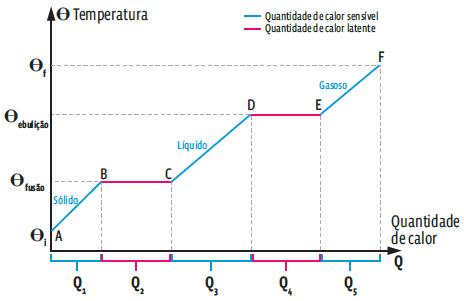
EM DEGRAUS Durante as mudanças de estado físico, a temperatura do corpo permanece constante. No gráfico acima, isso ocorre nos trechos BC (fusão) e DE (vaporização). Veja um exemplo no gráfico abaixo.
Para estudar a troca de calor entre diferentes materiais, os físicos utilizam o equipamento chamado calorímetro. Um calorímetro ideal é aquele que barra, completamente, a troca de calor entre o meio interno e o meio externo e que tem capacidade térmica desprezível. Na prática, não existem calorímetros perfeitos.
Considere um calorímetro ideal com certa massa de água, à temperatura ambiente. Se mergulharmos na água um bloco de chumbo a uma temperatura elevada, haverá uma transferência espontânea de energia do corpo mais quente (chumbo) para o corpo mais frio (água), até que o sistema água e chumbo atinja o equilíbrio térmico.
Se o calorímetro é ideal, não existe perda de energia para o meio externo. Então, toda a quantidade de calor perdida pelo chumbo é transferida para a água. Se durante a troca de calor entre os corpos o bloco de chumbo perdeu 100 calorias de energia, a água recebeu as mesmas 100 calorias de energia. Isso significa que, num sistema em um calorímetro ideal, a quantidade de energia cedida por um ou mais corpos que constituem o sistema é igual à quantidade de energia recebida pelos demais corpos. Em linguagem matemática:
![]()
Utilizando o mesmo raciocínio para um sistema formado por n corpos trocando calor dentro de um recipiente ideal, temos:
![]()
![]()
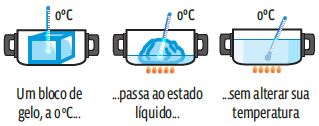
O calor latente L de uma mudança de fase pode ser positivo ou negativo, dependendo da mudança de fase ocorrida, se ela envolve ganho ou perda de calor. Para que um cubo de gelo de 1 grama sofra fusão, devemos fornecer 80 calorias. Então, podemos afirmar que o calor latente de fusão do gelo é de 80 cal/g. No sentido inverso, o calor latente de solidificação do gelo é de –80 cal/g.
Já para vaporizar 1 grama de água, precisamos fornecer 540 cal. Isso significa que o calor latente de vaporização da água é de 540 cal/g. No sentido inverso, o calor latente de condensação do vapor de água é de –540 cal/g (precisamos retirar essa quantidade de calor de cada grama).
![]()
Durante a mudança de estado físico, toda a energia térmica é usada na reorganização das moléculas. A temperatura não se altera.
![]()










