Estrutura da matéria: Ligações químicas
Um elemento químico pode fazer ligações cedendo, compartilhando ou ganhando elétrons

Dos 92 elementos encontrados na natureza, a maioria não existe na forma de átomo. No geral, as substâncias são formadas por átomos combinados com outros. O elemento oxigênio (O), por exemplo, está na água ligado ao hidrogênio (H) e no gás carbônico ligado ao carbono (C). Até o gás oxigênio da atmosfera é uma combinação de dois átomos desse elemento. Existe uma boa razão para isso: a configuração eletrônica da maioria dos átomos deixa-os instáveis. E, para alcançar a estabilidade química, os átomos se interligam.
Estabilidade Química: É uma estabilidade relacionada à energia dos elétrons, e não ao núcleo atômico. É quimicamente estável o átomo, ou o grupo de átomos, que tem elétrons em número adequado para se manter energeticamente estável.
Oito na camada de valência
Gilbert Lewis propôs, em 1916, um modelo que explica como os átomos se ligam. Lewis se baseou no único grupo de elementos que é encontrado na natureza em sua forma elementar (como átomo isolado): os seis gases nobres, ou gases raros – hélio (He), neônio (Ne), argônio (Ar), criptônio (Kr), xenônio (Xe) e radônio (Rn) –, todos pertencentes à família 18 da tabela periódica. Esses elementos são perfeitamente estáveis. Por isso, nunca se combinam com outros na natureza.
O ponto em comum que Lewis encontrou entre os átomos dos gases nobres é que todos têm oito elétrons em seu nível de valência (a última camada de elétrons). O único que foge à regra é o hélio (He): os dois elétrons desse elemento completam a camada K (1). Daí surgiu a teoria do octeto, segundo a qual atinge a estabilidade o átomo que tiver em sua última camada oito elétrons. Daí o fato de os átomos se ligarem uns aos outros, para compartilhar, ceder ou receber elétrons.
Teoria do octeto: A teoria do octeto não explica com perfeição todos os tipos de ligação química. As ligações que formam as substâncias metálicas, por exemplo, são explicadas por teorias mais complexas, que não constituem conteúdo do Ensino Médio.
Dois é bom, oito é melhor. Com exceção do hélio (He), todos os gases nobres têm oito elétrons na camada de valência. Com esse número, esses átomos não precisam se combinar com nada. Para o He bastam dois elétrons para completar a camada K (1).
Ligação iônica
É um dos tipos de ligação química explicados pela teoria do octeto. As ligações iônicas ocorrem entre átomos de eletronegatividade diferente – ou seja, um átomo que apresenta grande capacidade de atrair elétrons de outro, com capacidade menor. É o caso da ligação entre metais e não metais.
A ligação é feita pela transferência de elétrons. E se chama ligação iônica porque transforma átomos neutros em íons – cátions (que cederam elétrons) e ânions (que receberam elétrons). O resultado é um composto iônico.
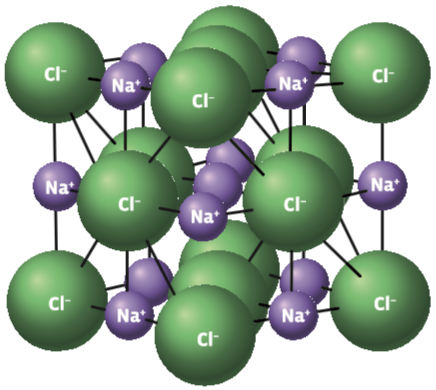
Ligações iônicas – ou seja, as que unem átomos na forma de cátions (com carga elétrica positiva) a ânions (com carga elétrica negativa) são muito fortes. E os íons unidos formam um aglomerado chamado retículo cristalino. Veja como é o retículo cristalino do cloreto de sódio (NaCl):
O flúor (F) e o alumínio (Al) podem formar um composto iônico chamado fluoreto de alumínio. Siga o raciocínio, passo a passo, para descobrir a fórmula desse composto:
- Primeiro, fazemos a configuração eletrônica de cada um dos átomos e verificamos o número de elétrons que cada um deles tem na camada de valência:

- Al tem apenas três elétrons na camada de valência. É mais fácil para o átomo ceder esses três elétrons e ficar estável com os oito da camada anterior. Mas o F já tem sete elétrons na última camada. Precisa só de mais um para ficar estável, com oito elétrons.
- Isso significa que são necessários três átomos de F para receber os três elétrons cedidos pelo Al. Ou seja, no composto fluoreto de alumínio, o Al tem de se ligar a três átomos de F.
- Ao ceder os elétrons, o Al se transforma no cátion de valência 3+ (Al3+). E cada átomo de F se transforma num ânion de valência 1– (F–).
- Então, a fórmula será AlF3. O índice 3, no pé da letra F de flúor, representa três átomos desse elemento.
Ligação covalente
É outro tipo de ligação explicada pela teoria dos octetos. Mas, ao contrário da ligação iônica, a ligação covalente ocorre com átomos que têm eletronegatividades próximas – por exemplo, entre dois não metais. Nesse caso, os átomos compartilham elétrons. Há dois tipos de ligação covalente: a normal e a dativa (ou coordenada).
Numa ligação covalente normal, os átomos contribuem com o mesmo número de elétrons a serem compartilhados. Os compostos formados por esse tipo de ligação não contêm íons. São chamados moléculas. É assim que se formam algumas das substâncias mais importantes para a vida, como a água e os gases hidrogênio e oxigênio.
O número de elétrons compartilhados indica o número de ligações covalentes entre os átomos. Veja o caso do gás oxigênio (O2), formado por dois átomos desse elemento (O):
- – O elemento químico O é um ametal (pertence à família 16, dos calcogênios). Como os demais elementos dessa família, o O tem seis elétrons na camada de valência. Sua configuração eletrônica é 1s2 2s2 2p4, em que L (2) = 6.
- – Com esses seis elétrons na camada L (2), cada átomo O precisa de mais dois elétrons para completar o octeto e ficar estável, com configuração semelhante à de um gás nobre, o neônio (Ne): 1s2 2s2 2p6, em que L (2) = 8.
- – Um átomo O pode receber esses dois elétrons de um metal, numa ligação iônica. Mas numa ligação com outro elemento não metal (ametal), a ligação será covalente.
- – Para que dois átomos O se unam, eles precisam compartilhar dois elétrons da camada de valência. Estabelecem-se, então, duas ligações covalentes – uma ligação dupla.

TEORIA DO OCTETO
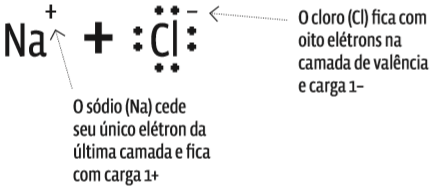
O sal de cozinha é o cloreto de sódio, um composto iônico formado da combinação de átomos de sódio (Na) com átomos de cloro (Cl). Veja como se dá essa ligação:
- No estado fundamental, o Na tem, ao todo, 11 elétrons;
- o átomo de Cl, também no estado fundamental, tem 17 elétrons no total.
Verifique a configuração eletrônica de cada um desses átomos:

A teoria do octeto diz: para serem estáveis, os átomos devem ter oito elétrons na última camada. Repare que:
- para o Na, é mais fácil ceder o elétron da camada de valência, M (3), e ficar com os oito da camada L (2);
- para o Cl, por outro lado, é mais fácil somar um elétron aos sete já existentes na sua camada de valência, M (3). Veja:

- Ao perder o único elétron que tem na camada de valência, o átomo de Na ficou com oito elétrons na última camada, L (2).
- De outro lado, o átomo de Cl pegou o elétron cedido pelo Na e completou a camada de valência, M (3), com oito elétrons.
- A ligação criou dois íons: o Na, que cedeu um elétron, transformou-se num cátion (Na+). O Cl, que recebeu um elétron, é agora um ânion (Cl–). Trata-se de uma ligação iônica.
- Compare a configuração eletrônica final dos dois íons com a distribuição dos elétrons nos gases nobres, na tabela ao lado. Observe que o cátion Na+ ficou com distribuição eletrônica igual à do neônio (Ne). Já a configuração do ânion cloreto (Cl–),é igual à do argônio (Ar). Ou seja, os íons Na+ e Cl– são tão estáveis quanto um gás nobre.

LIGAÇÃO COVALENTE
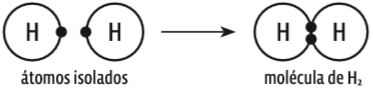
O gás hidrogênio é formado por dois átomos desse elemento. Veja como esses dois átomos se interligam:
- Cada átomo de hidrogênio (H) tem número atômico 1 (um próton) e, portanto, um único elétron: H (Z = 1) com distribuição eletrônica 1s1
- Nos dois átomos, esse elétron só pode estar na camada K (1): 1s1.
- Para ficarem estáveis, os átomos precisam completar a camada K, que deve ter dois elétrons. Então, eles compartilham seu único elétron, numa ligação covalente.
- Desse modo, cada átomo H fica com a configuração eletrônica 1s2, igual à de um gás nobre, o hélio (He). Graficamente, é isto o que acontece:
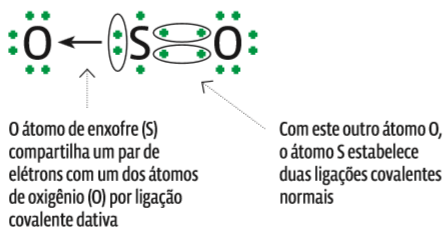
Ligação covalente dativa
Também chamada de ligação coordenada, ocorre quando um átomo “empresta” um par de elétrons para outro. Só faz uma ligação covalente dativa o átomo que:
- já tem todas as ligações covalentes normais necessárias para alcançar a estabilidade;
- mantém na camada de valência ao menos um par de elétrons livres, não envolvidos em nenhuma ligação;
- seja menos eletronegativo que o outro átomo (se for mais eletronegativo, ele será incapaz de emprestar elétrons).
Note que a ligação covalente dativa é semelhante à ligação covalente normal, já que, nos dois casos, temos envolvido um par de elétrons. A diferença é que:
- na covalente normal, cada átomo cede um elétron para formar o par compartilhado;
- na dativa, os dois elétrons do par compartilhado saem de apenas um dos átomos.

LIGAÇÃO COVALENTE DATIVA
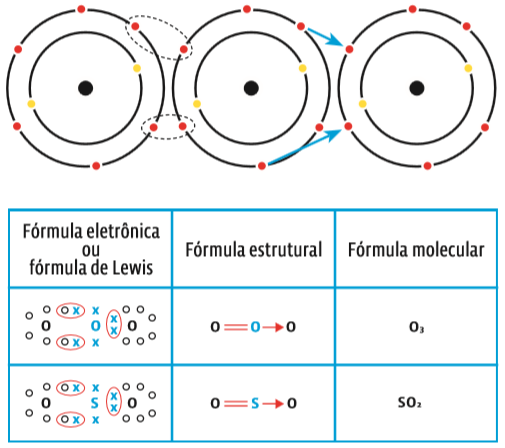
O ozônio, composto de três átomos de oxigênio (O3), inclui uma ligação covalente dativa. Veja na ilustração abaixo:
Ligação metálica
É a ligação química entre elementos classificados como metais. Essa ligação não forma moléculas, nem se explica pela teoria do octeto. Essa ligação se dá com parte dos átomos perdendo os elétrons da camada de valência e formando cátions. Nos metais, muitos cátions estão envolvidos por uma quantidade enorme de elétrons livres – um mar de elétrons.
Um metal se mantém sólido à temperatura ambiente (com exceção do mercúrio, Hg) por causa da força de atração entre os elétrons livres e os cátions, que é muito intensa.
Propriedades das substâncias
As substâncias iônicas se caracterizam por:
- Pontos de fusão e ebulição (PF e PE) muito elevados;
- Estado físico sólido à temperatura ambiente (25 °C). São cristais duros;
- Condutividade elétrica: não conduzem corrente elétrica em seu estado sólido, mas sim no estado líquido, ou quando dissolvidas em água.
Substâncias moleculares se caracterizam por:
- PE e PF baixos quando comparados aos das substâncias iônicas;
- Estado físico variável à temperatura ambiente (25 °C);
- Condutividade elétrica: as substâncias moleculares (substâncias puras) não conduzem corrente elétrica em nenhum estado físico. Mas, em solução aquosa em que se formam íons, são bons condutores de eletricidade;
As características principais dos metais são:
- – PE e PF elevados;
- – Estado físico: são sólidos à temperatura ambiente (25 °C), com exceção do mercúrio (Hg). Os metais são maleáveis, dúcteis (capazes de produzir fios), no geral brilhantes.
- – Condutividade elétrica alta. São também bons condutores de calor.


Nem sempre a ligação covalente dativa é indicada por seta, mas por traço, como são indicadas as covalentes comuns.
na
Fórmulas
Os compostos são representados por fórmulas. Existem fundamentalmente três tipos de fórmula: a química, a eletrônica e a estrutural, que representam os compostos iônicos e os moleculares.
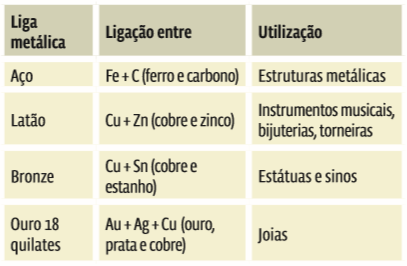
Não existem fórmulas para os metais puros nem para as ligas metálicas. Os metais puros são representados apenas pelo símbolo do elemento químico que o constitui: Fe para ferro, W para tungstênio e Au para ouro puro (24 quilates). As ligas metálicas são representadas comumente pela porcentagem de cada metal que a constitui. Por exemplo: o ouro 18 quilates tem 75% de ouro (Au).
Fórmula química é a que indica o tipo e o número de átomos envolvidos numa ligação:
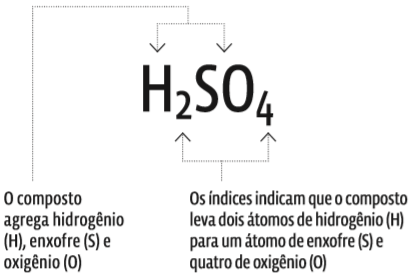
Para descobrir a natureza de um composto e sua fórmula, é preciso:
1. Conhecer o número de elétrons em sua camada de valência, lembrando que:
- Metais têm, geralmente, até quatro elétrons na camada de valência;
- Ametais têm de quatro a sete elétrons nessa camada.
2. Entender como esses elétrons participam da ligação atômica:
Entre ametais, as ligações são sempre covalentes. O número de elétrons que falta para o octeto de cada átomo é igual ao número de ligações covalentes que cada átomo deve fazer.
Num composto iônico, entre metais e ametais, os elétrons se combinam de outra maneira:
- Metais doam todos os elétrons da camada de valência e se transformam em cátions com valência (ou carga) 1+, 2+ ou 3+;
- Ametais recebem os elétrons que restam para completar o octeto e transformam-se em ânions com valência 3–, 2– ou 1–.
3. Por fim, a fórmula de um composto iônico deve igualar o número de elétrons cedidos ao número de elétrons recebidos entre os átomos:
- Se o cátion A tem valência x+, então precisará se ligar a x átomos do elemento B;
- Se o ânion B tem valência y–, então precisará de y átomos do elemento A.
Veja, abaixo, uma forma prática de definir a fórmula de um composto iônico.

FÓRMULA DE COMPOSTO IÔNICO
Raciocínio simples para igualar o número de elétrons cedidos e recebidos num composto iônico:
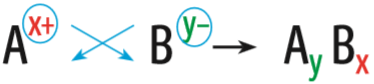
Perceba que íons com cargas opostas (1+ e 1–, ou 3+ e 3–) se ligam na proporção de um para um (1:1). Por exemplo, na ligação entre os íons cálcio (Ca2+) e oxigênio (O2–), a fórmula do composto é apenas CaO, porque basta um átomo de cada elemento para garantir a estabilidade.

Ligações entre átomos de diferentes metais constituem as ligas metálicas. Veja alguns exemplos de ligas:
A fórmula eletrônica, também chamada fórmula de Lewis, representa os elétrons da camada de valência de cada átomo e as ligações entre eles, sejam elas iônicas, sejam covalentes.
Para ligação iônica
Para ligação covalente normal

Para ligação covalente dativa
A fórmula estrutural representa apenas os dois tipos de ligação covalente, as covalentes normais e as dativas. As ligações covalentes normais são indicadas por traços, e as dativas, por setas. Veja como uma molécula de água é representada pelos três tipos de fórmula:


DISTRIBUIÇÃO ATÔMICA E LIGAÇÕES
Considere um elemento químico E em sua forma neutra que tem número atômico igual a 38.
a) Que tipo de ligação E tem tendência a realizar?
Primeiro, você deve saber que o número de elétrons num átomo é igual ao número de prótons, o número atômico (Z). Então, E tem 38 elétrons.
Segundo, lembre-se dos conceitos de ânion e cátion. Ânion é o íon de carga elétrica negativa – ou seja, um átomo que para atingir a estabilidade precisa ganhar elétrons.
Cátion é o oposto: um íon de carga positiva, com tendência a doar elétrons.
Para descobrir se E tende a ganhar ou perder elétrons, é preciso fazer a configuração eletrônica, distribuindo pelas camadas os 38 elétrons: Para E: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
Para ficar com 8 elétrons na última camada, é mais fácil para E perder os 2 elétrons da camada de valência do que ganhar 6 elétrons de outro elemento químico qualquer. Repare que, cedendo esses dois elétrons de 5s2, E ficará com 8 deles na camada N (4s2 4p6).
Assim, E tem tendência a doar elétrons numa ligação iônica (quando a ligação acontecer com um átomo que tem tendência a receber elétrons) ou metálica (quando a ligação acontecer com um outro átomo com a mesma tendência a doar elétrons).
b) Esse elemento químico formará um cátion ou um ânion?
Agora ficou fácil: se a tendência é de ceder elétrons, o átomo formará um cátion.
c) Represente a fórmula do composto neutro formado por E e o elemento químico Q, que tem um só elétron na camada de valência.
Temos E2+ e Q1– Lembrando o raciocínio para igualar o número de elétrons cedidos e recebidos no composto, ficamos com E1Q2. Ou seja: um átomo de E e dois átomos de Q formam um composto neutro.



















