Compostos orgânicos: Nomenclatura, representação e funções

A grande versatilidade do carbono faz desse elemento químico o principal componente dos seres vivos
Em 1828, contrariando todas as expectativas, o alemão Friederich Wöhler conseguiu sintetizar um composto orgânico, ureia, em laboratório. Mais significativo ainda é que a ureia foi obtida de cianato de amônio, uma substância mineral. Até então, acreditava-se que os compostos orgânicos – aqueles que contêm carbono (C) – eram produzidos só por seres vivos. Desde a realização de Wöhler, muitos outros compostos foram sintetizados em laboratório, e a química orgânica deixou de ser a química dos seres vivos para se tornar o ramo que estuda os compostos de carbono.
Seres vivos: O sueco Jöns Jakob Berzelius esquematizou a ideia de que só seres vivos sintetizavam compostos de carbono na chamada teoria da força vital.
O elemento químico carbono
O carbono merece um ramo inteiro da química. Esse elemento químico tem algumas características que lhe conferem propriedades únicas.
→ Um átomo de carbono tem quatro elétrons em sua camada de valência e, por isso, para completar o octeto (oito elétrons na última camada), precisa fazer quatro ligações covalentes com outros átomos. Essas ligações podem ser simples, duplas ou triplas. Veja:
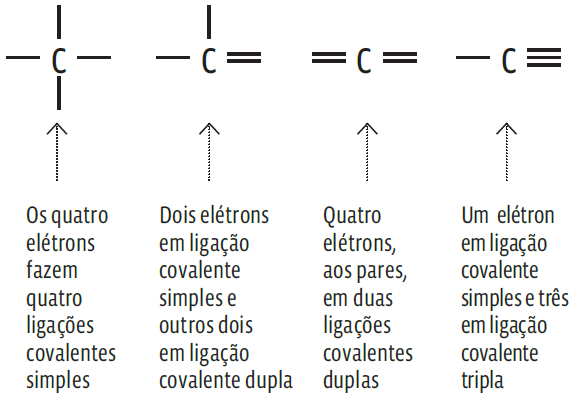
Essa versatilidade na forma de compartilhar seus quatro elétrons permite que o carbono estabeleça grande variedade de ligações.
→ Os carbonos podem se unir e formar longas cadeias, eventualmente incluindo átomos de outros elementos:
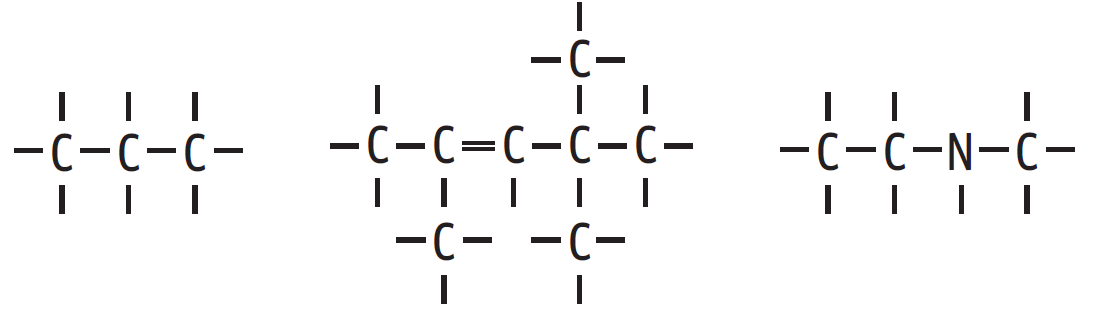
Além do carbono, os elementos químicos que mais aparecem nos compostos químicos são: hidrogênio (H), oxigênio (O), nitrogênio (N) e enxofre (S). Todos esses elementos são ametais que fazem ligações covalentes entre si e com o carbono. Por isso, são raros os compostos iônicos entre as substâncias orgânicas. A maioria é molecular (sobre ligações iônicas e moleculares, veja capítulo 1).
Representação
Os compostos orgânicos podem ser representados de muitas maneiras. A tabela abaixo traz algumas delas.
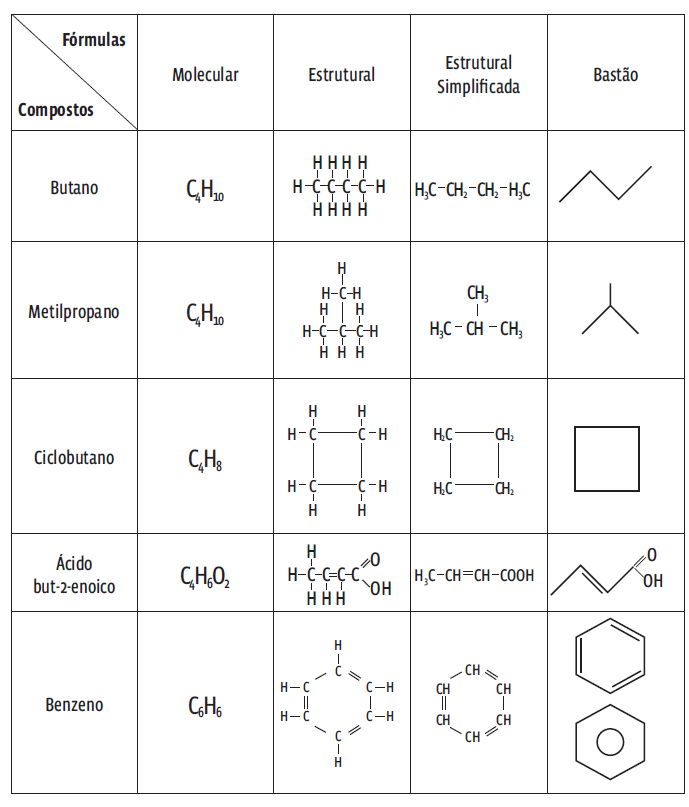
Não se preocupe com o nome desses compostos por enquanto. Mas repare nas características e nas limitações de cada fórmula. Acompanhe na tabela:
→ Uma mesma fórmula molecular pode indicar diversos compostos. Butano e metilpropano, por exemplo, têm como fórmula C4H10, mas são substâncias diferentes, com propriedades particulares. Isso confunde a identificação do composto. Por isso, as fórmulas moleculares não costumam ser utilizadas na química orgânica.
→ A fórmula estrutural também é pouco utilizada porque estruturas maiores são muito difíceis de visualizar.
→ As fórmulas mais utilizadas são a estrutural simplificada e a bastão. Repare que na fórmula bastão a cadeia carbônica é mostrada como um zigue-zague, e os átomos de hidrogênio da cadeia costumam ser omitidos. Os demais átomos devem estar sempre explícitos, como no exemplo abaixo:
 Uma cadeia de carbono pode ser aberta ou fechada. Na cadeia aberta, os átomos de carbono organizam-se em linha (como no exemplo do butano, na tabela). Na cadeia fechada, esses átomos se fecham num anel, ou um ciclo. Esse é o caso do ciclobutano.
Uma cadeia de carbono pode ser aberta ou fechada. Na cadeia aberta, os átomos de carbono organizam-se em linha (como no exemplo do butano, na tabela). Na cadeia fechada, esses átomos se fecham num anel, ou um ciclo. Esse é o caso do ciclobutano.
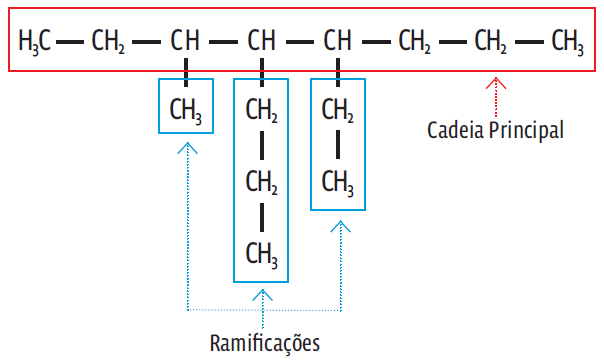
Cadeia principal é a que contém o maior número de átomos de carbono entre as extremidades. Os outros átomos “pendurados” como enfeites de árvore de Natal são as ramificações (R). É importante conhecer as principais ramificações porque são esses grupos de átomos que definem a natureza do composto.
Veja uma cadeia ramificada:
Nomenclatura
A nomenclatura dos compostos orgânicos segue um princípio rígido: cada composto orgânico tem o próprio nome, e esse deve ser deduzido da fórmula estrutural do composto. O inverso também deve ser verdadeiro: a estrutura deve
indicar o nome exato do composto. A lista de regras adotadas sobre esse princípio básico, para definição de nomes dos compostos, é muito longa. Por isso, no Ensino Médio, estudamos compostos cujos nomes seguem uma regra mais simples, básica: todo nome de composto orgânico é dado por
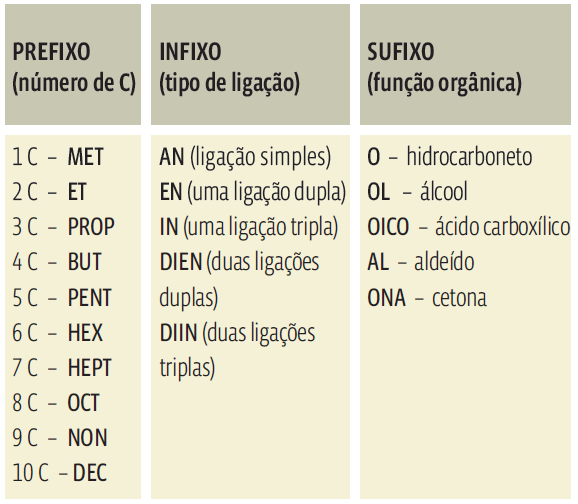
PREFIXO + INFIXO + SUFIXO
-
- → Prefixo indica o número de átomos de carbono da cadeia principal;
- → Infixo indica o tipo de ligação existente entre carbonos da cadeia principal – simples,
dupla ou tripla; - → Sufixo indica a função orgânica à qual o composto pertence.
- Veja cada um desses elementos abaixo:
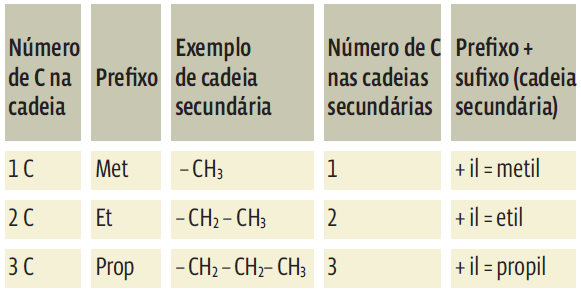
As ramificações também recebem nomes de acordo com o número de átomos de carbono que contêm. Nesse caso, ao prefixo que indica o número de carbonos da cadeia principal adiciona-se o sufixo il:
Orgânica em Botijão
Os botijões usados nas cozinhas contêm gás liquefeito de petróleo (GLP), uma mistura dos hidrocarbonetos butano e propano.

Prefixo, infixo e sufixo
• Pelas regras de nomenclatura, o metano:
→ tem um carbono na cadeia principal (prefixo met);
→ o carbono faz ligações simples (infixo an);
→ o composto é um hidrocarboneto (sufixo o).
Então, sua fórmula estrutural é:
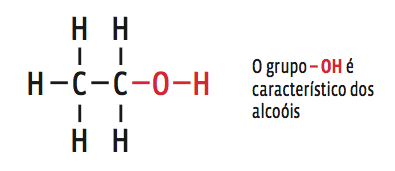
• Pelas mesmas regras, o etanol:
→ tem dois carbonos na cadeia principal (prefixo et);
→ os carbonos fazem ligações simples (infixo an);
→ o composto é um álcool (sufixo ol).
Então, sua fórmula estrutural é:
Ou, na forma estrutural simplificada:
CH3 – CH2 – OH
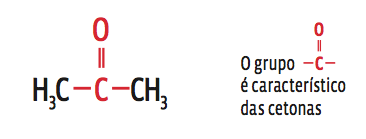
• Podemos também deduzir o nome de um composto a partir de sua fórmula estrutural.
Para a fórmula:
→ São três carbonos, então prefixo prop;
→ todos os carbonos são unidos por ligações simples (infixo an);
→ para descobrir o sufixo, é preciso reconhecer na fórmula os grupos de átomos que definem a função do composto. Neste caso, a dupla ligação do carbono com o oxigênio caracteriza a função cetona (sufixo ona).
Então, o composto é prop / an / ona: propanona.
Hidrocarbonetos
São compostos formados apenas de carbono (C) e de hidrogênio (H). Com exceção do metano, eles se formam sob condições de alta pressão e temperatura e sofrem combustão facilmente. Por isso, são importantes combustíveis dos séculos XX e XXI. O gás natural é metano. O petróleo e o carvão mineral são misturas de hidrocarbonetos. Os hidrocarbonetos são divididos em diversas classes de compostos, segundo o tipo de cadeia formada e de ligações entre os carbonos. Veja a tabela abaixo.
O benzeno – também chamado anel benzênico ou aromático – é uma cadeia de seis átomos de carbono unidos por ligações simples e duplas, intercaladas. O anel pode ser representado de duas formas:
Posições numeradas
Para definir a posição de insaturações, grupos funcionais e ramificações, recorremos a números, que passam a integrar o nome do composto. Para numerar a cadeia principal, seguimos a regra:
→ Caso exista um grupo funcional, começar a numeração pelo carbono da extremidade mais próxima dele;
→ Na ausência de um grupo funcional, come- çar na extremidade mais próxima de uma insaturação (ligação dupla ou tripla);
→ E, se houver apenas ramificações, iniciar pela extremidade mais próxima de uma delas.