Compostos orgânicos: Propriedades físicas

A solubilidade de um composto depende das forças entre as moléculas e entre seus átomos
Os vários grupos de átomos presentes nos compostos orgânicos determinam propriedades diferentes para cada um deles. Vamos, agora, juntar vários pontos que já conhecemos:
• A maioria dos compostos orgânicos são moléculas, formadas por ligações covalentes;
• Nas moléculas, sejam elas orgânicas, sejam inorgânicas, os átomos compartilham elétrons para tornar-se estáveis segundo a regra do octeto;
• Esse compartilhamento pode ser desigual, como no caso da água: o oxigênio é um átomo muito mais eletronegativo que o hidrogênio, e atrai os elétrons com maior força – formando um dipolo. Esse tipo de molécula é chamado molécula polar.
Portanto, podemos determinar a polaridade também dos compostos orgânicos, sempre pensando na diferença de eletronegatividade dos átomos.
Polaridade
Nas cadeias de carbono, os átomos se unem por ligações covalentes. Se os átomos de carbono dividem igualmente seus elétrons, não existe diferença de eletronegatividade de um lado ou de outro da cadeia. O mesmo acontece com cadeias de carbono e hidrogênio. Esses elementos têm eletronegatividades muito próximas. Portanto, o compartilhamento de elétrons entre seus átomos é bem equilibrado. Daí, os hidrocarbonetos, que só contêm carbonos e hidrogênios, são sempre substâncias apolares.
Mas um composto orgânico, em que exista outro elemento químico além do carbono e do hidrogênio, pode ser polar. Só depende do tamanho da cadeia principal e da eletronegatividade dos grupos funcionais “pendurados” na cadeia principal.
Nas funções oxigenadas e nitrogenadas, as ligações entre o carbono e os átomos de oxigênio ou nitrogênio são desiguais, pois a eletronegatividade do carbono e dos dois outros elementos é muito diversa. Além disso, as funções oxigenadas ou nitrogenadas podem, ainda, conter hidrogênios ligados a outros oxigênios ou nitrogênio. Nesse caso, também há diferença de eletronegatividade e, portanto, forma-se um dipolo – literalmente, dois polos, um positivo, outro negativo.
Então, os compostos de funções oxigenadas e nitrogenadas têm sempre uma parte apolar (a cadeia carbônica que apresenta apenas átomos de carbono ligados a átomos de hidrogênio) e uma parte polar, em que há a formação de um dipolo.
No entanto, as moléculas orgânicas apresentam sempre um equilíbrio de forças: aquelas que têm um dipolo mas a parte apolar é pequena (contendo de um a quatro átomos de carbono, apenas) são predominantemente polares. Veja dois exemplos de moléculas desse tipo:

Se a cadeia de carbono é grande (com mais de quatro átomos), mesmo que a molécula apresente um dipolo, dizemos que ela é predominantemente apolar. É o que acontece com os óleos essenciais, usados nas indústrias alimentícia e farmacêutica:

Geraniol O dipolo está na função álcool (C – OH). Mas a cadeia de carbonos é muito grande. Molécula predominantemente apolar
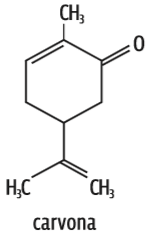
Carvona O dipolo está na função cetona (C = O). Mas, de novo, é grande o número de átomos de carbono. Então, a molécula é predominantemente apolar
Polaridade e solubilidade
Já vimos na química inorgânica:
• Para que um composto qualquer se dissolva em outro, é preciso que haja algum tipo de interação entre soluto e solvente;
• Na dissolução de compostos iônicos em água, a interação ocorre entre os íons do composto e os dipolos da água (veja no capítulo 3);
• Também para os compostos moleculares, para que haja dissolução, tem de haver interação entre as moléculas do solvente (água) e do soluto. Moléculas polares interagem com moléculas polares, e moléculas apolares, com moléculas apolares. A regra geral: semelhante dissolve semelhante.
Tudo isso é válido também para os compostos orgânicos.
Os hidrocarbonetos são sempre apolares e, por isso, sempre insolúveis em água. Moléculas predominantemente apolares como os óleos e as gorduras também são insolúveis em água. Já o etanol, o ácido acético e os açúcares, como a glicose e a frutose, são compostos predominantemente polares – o que lhes garante grande solubilidade em água. Na dissolução, os grupamentos polares interagem com as moléculas da água e, assim, o composto se dissolve. Veja abaixo os grupamentos polares de dois compostos:

De outro lado, a vitamina A (retinol) e a vitamina D (calciferol) são moléculas predominantemente apolares e, portanto, pouco solúveis em água. Mas são solúveis em gorduras, que são predominantemente apolares. Veja:
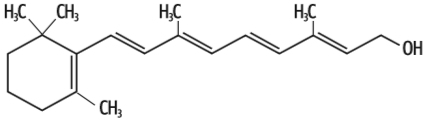
Vitamina A As moléculas de retinol contêm grande número de carbonos. Por isso, apesar de terem uma região de dipolo, são predominantemente apolares. Assim, só se dissolvem bem em solventes também apolares, como as gorduras
Hidrocarbonetos – O QUE ISSO TEM A VER COM BIOLOGIA? A diferença de polaridade entre o petróleo e a água é o que torna um derramamento de óleo no mar um desastre ambiental. As cadeias de hidrocarboneto apolares não se dissolvem na água. O óleo forma uma película à tona d’água, que impede a entrada de luz e as trocas gasosas entre mar e atmosfera. Isso afeta toda a cadeia alimentar marinha, a começar pelos fitoplânctons, impedidos de fazer a fotossíntese.
FORÇAS INTERMOLECULARES
São as forças de atração entre uma molécula e sua vizinha. A alteração do estado físico de uma substância depende da intensificação ou destruição dessas forças. No estado sólido, as moléculas estão mais próximas. Por isso, apresentam interações intensas. No estado líquido, mais afastadas, as moléculas interagem mais fracamente. No estado gasoso, essas forças simplesmente não existem.
Quanto mais intensas são essas interações, mais difícil é mudar o estado físico de um material, porque a destruição das forças intermoleculares exige mais energia. Daí, podemos concluir que, quanto mais intensas forem as forças intermoleculares, mais altos serão o ponto de fusão (PF) e o ponto de ebulição (PE).

O que mantém a água no estado sólido ou líquido são pontes de hidrogênio. Uma única molécula pode atrair até quatro outras moléculas. Veja:

Comparada quanto mais intensas forem as forças intermoleculares, mais altos serão o ponto de fusão (PF) e o ponto de ebulição (PE)s às ligações covalentes e iônicas, que unem os átomos, as forças intermoleculares são fracas. Essas forças surgem devido à diferença de polaridade das moléculas e são diferentes para moléculas polares e apolares.
Comparadas às ligações covalentes e iônicas, que unem os átomos, as forças intermoleculares são fracas. Essas forças surgem devido à diferença de polaridade das moléculas e são diferentes para moléculas polares e apolares.
• As moléculas apolares interagem pelas forças de London, ou forças de Van der Waals, as mais fracas de todas. São substâncias que apresentam os menores pontos de fusão e de ebulição entre os compostos orgânicos. Mas, quanto maior a cadeia carbônica, maior a molécula e, também, maior a interação entre elas. Isso significa que entre as moléculas apolares, o PF e o PE sobem à medida que a molécula cresce. Confira na tabela abaixo

• Já as moléculas polares podem interagir por meio de dois tipos de força: os dipolos permanentes e as pontes de hidrogênio (ou ligações de hidrogênio). Cetonas, aldeídos, éteres e ésteres não fazem pontes de hidrogênio. Suas moléculas interagem por dipolos permanentes. As pontes de hidrogênio se formam apenas quando, na molécula, um hidrogênio se liga ao flúor, ao oxigênio ou ao nitrogênio (F, O, N). As pontes aparecem nos alcoóis, fenóis, ácidos carboxílicos, aminas e amidas.

Pontes de hidrogênio Todos estes compostos orgânicos contêm um átomo de hidrogênio ligado ao oxigênio ou ao nitrogênio
As pontes de hidrogênio são mais poderosas que os dipolos permanentes. Por isso, os compostos que contêm ligações de hidrogênio entre suas moléculas têm maiores PF e PE, se comparados com os que interagem apenas por dipolos ou por forças de London. Nesse caso, também, quanto maior a molécula (quanto maior for a massa molar da substância), mais altos serão os PF e PE das substâncias. Veja na tabela abaixo:


Ligações interatômicas são as que ocorrem entre os átomos para formar uma substância. Forças intermoleculares são as interações que ocorrem entre as moléculas, que põem a substância no estado sólido ou líquido.





















