Cálculos químicos: Grandezas (mol, massa atômica, molar e molecular)
Massa atômica, massa molecular, mol e massa molar

CILADA ATÔMICA Isto é uma roda de 48 átomos de ferro (picos amarelos) sobre uma superfície de cobre. As ondas azuis, no centro, são elétrons de átomos de cobre, presos na armadilha
Pequeno, pequeno, mesmo
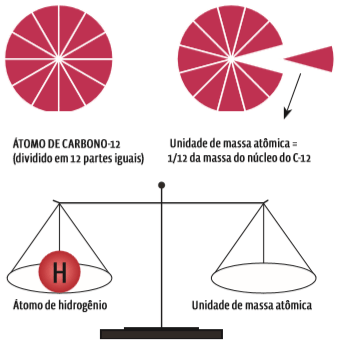
Para definir a massa dos minúsculos átomos, os cientistas criaram um padrão, fatiando o átomo de carbono
A quantidade de uma substância no organismo humano costuma ser dada em miligramas (mg) ou em mililitros (mL). Mas, para medir grandezas como massa e volume de corpos minúsculos, como átomos e moléculas, os químicos precisam de padrões especiais. O conjunto de átomos na imagem acima, por exemplo, mede alguns nanômetros. Um nanômetro é um bilionésimo de metro (10–9 m, ou 0,000000001 metro). Isso é muito pequeno, mesmo: você chega a 1 nanômetro se dividir 1 milímetro em 1 milhão de partes e separar apenas uma. A química tem também padrões especiais para medir quantidades no mundo atômico – o número de átomos e moléculas de uma amostra e a massa de cada uma dessas partículas de matéria.
O padrão massa atômica
Um átomo é tão pequeno que no ponto final desta frase existem milhões deles. A maior parte da massa de um átomo está no núcleo. Por isso, quando falamos em massa do átomo, consideramos apenas a massa de prótons e nêutrons. Mas essa medida é absurdamente pequena para ser expressa em qualquer padrão usado no dia a dia, como o grama (g). Em química, o padrão para expressar a massa dos átomos é a unidade de massa atômica (u). Uma unidade de massa atômica foi definida tomando por base o átomo de carbono-12 – o isótopo de carbono que tem número de massa igual a 12. Ao átomo de C-12 foi atribuída arbitrariamente massa atômica (MA) de 12 unidades de massa atômica (12 u). Então, uma unidade de massa atômica equivale a 1/12 da massa atômica do carbono-12.

O número de massa (A) é o total de partículas que definem a massa de um átomo – prótons e nêutrons no núcleo. A massa atômica (MA) é a medida dessa massa.
A massa atômica medida
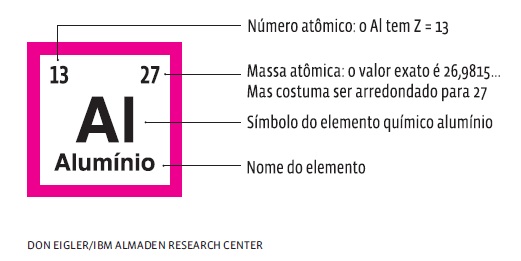
Como o nome diz, o padrão unidade de massa atômica (u) é usado para medir a MA dos átomos. O átomo do hidrogênio (H), o mais leve de todos os elementos, tem massa de 1 u – ou seja, sua MA é 1/12 vezes a massa de um átomo de carbono-12. O hidrogênio, que tem apenas um próton, tem MA = 1 u. Podemos comparar a massa de todos os átomos à do hidrogênio. Então, por exemplo, a massa atômica do alumínio (Al) é 27 u. Isso significa que são necessários 27 átomos H para chegar à massa de um átomo Al. Portanto, um átomo Al tem MA = 27 u. A massa atômica de cada elemento foi medida experimentalmente em laboratório. E esse dado é fornecido nas tabelas periódicas mais completas. No geral, aparecem com valores arredondados.
Massa molecular
É a massa de todos os átomos que formam uma molécula. Para descobrir a massa molecular (MM) de uma substância, basta, então, somar a massa atômica (MA) dos elementos que a constituem. O gás hidrogênio (H2), por exemplo, leva dois átomos de hidrogênio. A MM do gás hidrogênio é 2 u, a soma da MA de cada átomo.

O mol
Contar o número de átomos, moléculas ou íons de uma substância é tarefa impossível a olho nu. Apenas microscópios eletrônicos, de varredura, conseguem captar alguma imagem dos átomos, como a da foto da página 60. Para calcular quantos átomos, moléculas ou íons existem em determinado volume de uma substância, a química usa a grandeza chamada mol (pela regra oficial, não existe plural de mol: 1 mol, 2 mol, 3 mol etc.).
Mol mede simplesmente a quantidade de matéria. E tem o mesmo papel que a palavra dúzia. Assim como uma dúzia contém 12 unidades, um mol contém cerca de 6 . 1023 unidades. Assim como a dúzia pode ser usada para bananas, ovos ou parafusos, a unidade mol é empregada para medir o número de átomos, íons ou moléculas.
O mol foi adotado para todos os átomos e substâncias também com base nos átomos de C-12. Por medição direta, os químicos descobriram que 12 gramas de C-12 contêm 6,02 . 1023 átomos – valor que arredondamos para 6 . 1023. Daí surgiu o padrão chamado constante de Avogadro: 1 mol = número de átomos em 12 gramas de C-12 = 6 . 1023 átomos.
Esse número padrão foi adotado para contar o número de qualquer tipo de partícula: átomos, moléculas ou íons:
- • 1 mol de moléculas são 6 . 1023 moléculas
- • 1 mol de átomos são 6 . 1023 átomos
- • 1 mol de íons são 6 . 1023 íons
Podemos calcular quantos átomos existem em 1 mol de determinada substância. É como calcular o número de patas em um rebanho: se cada boi ou vaca tem quatro patas e se o rebanho tem 80 reses, o número de patas é 320. Agora imagine que vamos contar o número total de patas do rebanho de 80 reses mais dez galinhas. Pelo mesmo raciocínio, teremos 80 . 4 + 10 . 2 = 340 patas. Para contar o número de átomos de um mol de água fazemos o mesmo:
- • A fórmula da água: H2O;
- • 1 mol de água contém 6 . 1023 moléculas H2O.
Então 1 mol de água contém:
- • Uma molécula de água contém dois átomos H e um átomo O;
- • 1 mol de átomos O: 6 . 1023 átomos
- • 2 mol de átomos H: 2. 6 . 1023
- • No total, 1 mol de moléculas de H2O contém (12 + 6) . 1023 átomos = 18 . 1023 átomos, ou 1,8 . 1024 átomos.

A massa molar é numericamente igual à massa molecular (MM) ou à massa atômica (MA). Só o que muda é a unidade:
para MM, a unidade é u (unidades);
para a massa molar (M), a unidade é g/mol (grama por mol).
Massa molar
A massa molar (M) é a massa de 1 mol de átomos, moléculas ou íons, dada em gramas. Se conhecemos a massa atômica (MA) de um elemento químico, podemos calcular a massa molar, ou seja, a massa de 1 mol de átomos desse elemento. É o mesmo que calcular o preço de uma dúzia de barras de chocolate, sabendo-se quanto custa apenas uma delas.

A equivalência entre massa atômica, massa molecular e a massa em gramas de uma substância é muito útil para comparações.


• 18 u é a massa molecular (MM) da água, isto é, quantas vezes a molécula de água é mais pesada em relação a u;
• 18 g é a massa molar da água, isto é, a massa que contém 6 . 1023 moléculas de água;
• a massa de uma molécula de água (H2O), em gramas, é 3 . 10 – 23 g.




















