Transformações: Óxidos iônicos
VERMELHO DE CORROSÃO A ferrugem, que ataca as superfícies metálicas, é uma reação do ferro com oxigênio e a água existente no ar, que resulta num hidróxido
Casamentos perfeitos
Combinando-se com metais ou ametais, o oxigênio forma compostos estáveis e poderosos
Óxidos são substâncias binárias, aquelas formadas por dois elementos químicos.Um desses é, obrigatoriamente, o oxigênio(O). O outro elemento pode ser um metal ou um ametal. Num óxido, o oxigênio é sempre o elemento mais eletronegativo.
Quando se liga a um metal, o oxigênio estabelece uma ligação iônica. Se unindo a um ametal, a ligação é covalente. Dessa forma, existem dois tipos de óxido: os iônicos e os moleculares.
Óxidos iônicos
Os metais usados no dia a dia são obtidos da purificação de minérios. E grande parte desses minérios é constituída de óxidos iônicos.
Os óxidos iônicos são nomeados de acordo com o metal que se liga ao oxigênio. Isso significa que o número de átomos de oxigênio que compõem um óxido iônico não importa para o nome de um óxido iônico. Mas é claro que, na fórmula, esse número tem de ser balanceado com a valência do outro elemento. Veja os exemplos abaixo:
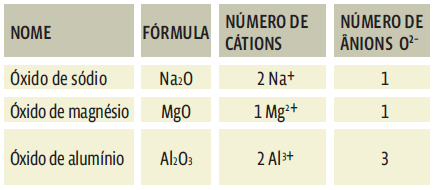
 A maioria dos óxidos iônicos tem uma propriedade importante: reage com a água, formando uma base, um hidróxido. Isso ocorre especialmente entre os óxidos de metais alcalinos e os alcalino-terrosos (famílias 1 e 2 da tabela periódica). Veja:
A maioria dos óxidos iônicos tem uma propriedade importante: reage com a água, formando uma base, um hidróxido. Isso ocorre especialmente entre os óxidos de metais alcalinos e os alcalino-terrosos (famílias 1 e 2 da tabela periódica). Veja:
Na2O + H2O → 2 NaOH
(óxido de sódio + água = hidróxido de sódio)
CaO + H2O → Ca(OH)2
(óxido de cálcio + água = hidróxido de cálcio)
Por essa propriedade, os óxidos iônicos podem ser usados para neutralizar os ácidos, criando a partir deles um sal.
Óxidos moleculares
São aqueles que se formam da ligação entre o oxigênio e qualquer ametal. A única exceção é o flúor. Muitos óxidos moleculares são gasosos.É o caso do gás carbônico (CO2) e do monóxido de carbono (CO).
Flúor: Num óxido, o oxigênio é sempre o elemento mais eletronegativo (tem maior facilidade de receber elétrons).
Como o flúor é o único elemento mais eletronegativo que o oxigênio, não existem óxidos de flúor.
Nos óxidos moleculares, o oxigênio pode se combinar em diversas proporções ao outro elemento químico. Por exemplo, existem seis óxidos de nitrogênio: NO, NO2, N2O, N2O3, N2O4 e N2O5.O número de átomos O varia para balancear o número de átomos N. Mas todas essas substâncias são óxidos.
Para identificar o número de átomos que compõem um óxido molecular, usamos prefixos:
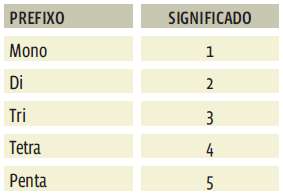
Esses prefixos são usados tanto para indicar o número de átomos O quanto o número de átomos do outro elemento químico do composto. Então, termos como “di”, “tri” ou “tetra” podem aparecer duas vezes no nome de um óxido. Veja:
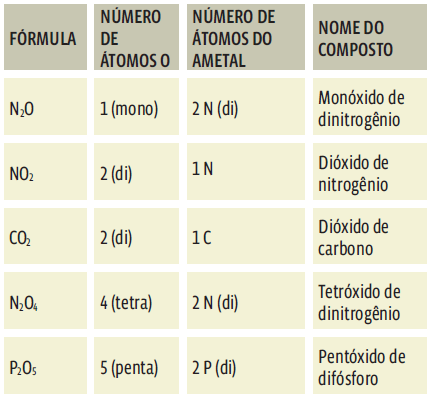
Repare que o prefixo “mono” não é usado para o ametal. Não dizemos dióxido de monocarbono, mas dióxido de carbono, apenas.
Os óxidos e a atmosfera
Os óxidos moleculares podem reagir com a água e formar ácidos. A atmosfera é rica em umidade.Assim, é fácil que ocorram reações que produzam ácidos. Em outras palavras, os óxidos moleculares podem ser grandes agentes poluidores.
Alguma proporção de óxidos moleculares na atmosfera é natural. O problema está no aumento dessa proporção, causado pelas atividades humanas. É o caso do gás carbônico (dióxido de carbono, CO2).
O excesso de CO2 não tem como efeito apenas o aumento do efeito estufa e as consequentes alterações climáticas . Esse gás, ao reagir com a água, cria ácido carbônico. Outros óxidos produzem outros ácidos, como o sulfuroso e o sulfúrico. Juntos,esses ácidos criam as chuvas ácidas, que afetam o solo, a vegetação e os mananciais, além de comprometerem as estruturas de concreto e metal construídas pelo homem.
Numa ligação iônica, o átomo oxigênio (O) sempre recebe dois elétrons e se transforma no ânion O2–. O número de átomos O depende da carga (positiva) do cátion que compõe o óxido iônico.




















