Química: Simulado (Perguntas)
CAPÍTULO 1
1. (Uerj 2014) A tabela abaixo apresenta o nome de alguns minerais e a fórmula química da substância que constitui cada um deles.
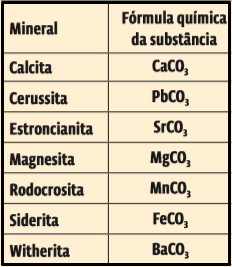
Considerando a tabela, apresente o nome do mineral cujo metal no estado fundamental possui quatro elétrons na sua camada de valência. Apresente, também, a fórmula química da substância que contém o metal de maior raio atômico.
2. (Fuvest 2015) Cinco cremes dentais de diferentes marcas têm os mesmos componentes em suas formulações, diferindo, apenas, na porcentagem de água contida em cada um. A tabela a seguir apresenta massas e respectivos volumes (medidos a 25 °C) desses cremes dentais.
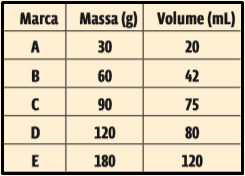
Supondo que a densidade desses cremes dentais varie apenas em função da porcentagem de água, em massa, contida em cada um, pode-se dizer que a marca que apresenta maior porcentagem de água em sua composição é
(Dado: densidade da água (a 25 °C) = 1,0 g/mL)
a) A.
b) B.
c) C.
d) D.
e) E.
3. (UTFPR 2014) O desastre nuclear ocorrido na usina nuclear de Fukushima I, localizada no Japão, tem sido considerado o maior acidente nuclear da história. Devido a esse acidente foram detectados vazamentos principalmente de 53I137 e 55Cs137, que contaminaram a água próxima da usina. A respeito dessa informação assinale a alternativa correta.
a) Os elementos iodo e césio apresentam o mesmo número de nêutrons.
b) Os elementos iodo e césio são isóbaros.
c) O iodo tem número atômico maior que o césio.
d) A água é uma substância pura simples.
e) O césio tem número de massa maior que o iodo.
4. (PUC-RS 2014) Em 2013, comemorou-se o centenário da publicação de um trabalho que marcou época no desenvolvimento da teoria atômica. Intitulado Sobre a constituição de átomos e moléculas, o trabalho oferece uma descrição da estrutura atômica na qual os elétrons descrevem órbitas bem definidas e podem saltar de uma órbita a outra mediante a absorção ou emissão de radiação. _________, o autor desse trabalho, elaborou seu modelo atômico tomando as ideias de Rutherford como ponto de partida. Segundo Rutherford, o átomo contém um núcleo positivo muito pequeno, ao redor do qual se movem os elétrons. Assim surgiu a famosa imagem do átomo como _________, a qual substituiu a noção de _________ de que o átomo seria semelhante a _________.
As expressões que completam corretamente o texto são, respectivamente:
a) Bohr, um sistema solar em miniatura, Thomson, um pudim de passas.
b) Bohr, um pudim de passas, Dalton, uma bola de bilhar.
c) Thomson, um sistema solar em miniatura, Dalton, um pudim de passas.
d) Thomson,um pudim de passas, Demócrito, uma bola de bilhar.
e) De Broglie, um sistema solar em miniatura, Thomson, uma bola de bilhar.
5. (Fuvest 2015) Quando começaram a ser produzidos em larga escala, em meados do século XX, objetos de plástico eram considerados substitutos de qualidade inferior para objetos feitos de outros materiais. Com o tempo, essa concepção mudou bastante. Por exemplo, canecas eram feitas de folha de fandres, uma liga metálica, mas, hoje, também são feitas de louça ou de plástico. Esses materiais podem apresentar vantagens e desvantagens para sua utilização em canecas, como as listadas a seguir:
I. ter boa resistência a impactos, mas não poder ser levado diretamente ao fogo;
II. poder ser levado diretamente ao fogo, mas estar sujeito a corrosão;
III. apresentar pouca reatividade química, mas ter pouca resistência a impactos.
Os materiais utilizados na confecção de canecas os quais apresentam as propriedades I, II e III são, respectivamente,
a) metal, plástico, louça.
b) metal, louça, plástico.
c) louça, metal, plástico.
d) plástico, louça, metal.
e) plástico, metal, louça.
CAPÍTULO 2
6. (UPF 2014, adaptado) A combustão completa da vela, sem o ajuste dos coeficientes estequiométricos, pode ser representada genericamente pela equação:
C20H42 + O2(g) → CO2(g) + H2O(g)
Considerando que vários fatores podem interferir na rapidez de uma reação química, analise as afirmações a seguir e marque V para verdadeiro e F para falso:
( ) Fatores como o aumento da temperatura e da concentração dos reagentes influenciam na rapidez de uma reação e sempre a tornam mais lenta.
( ) Para que uma reação ocorra, é necessário que haja colisão entre as moléculas, orientação favorável e energia suficiente.
( ) No processo descrito, se a vela for coberta com um recipiente, é possível que a chama se apague.
( ) Ao aumentar a superfície de contato dos reagentes, a rapidez da reação não será afetada, o que implica maior tempo de reação.
7. (Espcex/Aman 2015) “Uma amostra de açúcar exposta ao oxigênio do ar pode demorar muito tempo para reagir. Entretanto, em nosso organismo, o açúcar é consumido em poucos segundos quando entra em contato com o oxigênio. Tal fato se deve à presença de enzimas que agem sobre as moléculas do açúcar, criando estruturas que reagem mais facilmente com o oxigênio…”.
Adaptado de Usberco e Salvador, Química, vol 2, FTD, SP, pág 377, 2009.
Baseado no texto acima, a alternativa que justifica corretamente a ação química dessas enzimas é:
a) As enzimas atuam como inibidoras da reação, por ocasionarem a diminuição da energia de ativação do processo e, consequentemente, acelerarem a reação entre o açúcar e o oxigênio.
b) As enzimas atuam como inibidoras da reação, por ocasionarem o aumento da energia de ativação do processo e, consequentemente, acelerarem a reação entre o açúcar e o oxigênio.
c) As enzimas atuam como catalisadores da reação, por ocasionarem o aumento da energia de ativação do processo, fornecendo mais energia para a realização da reação entre o açúcar e o oxigênio.
d) As enzimas atuam como catalisadores da reação, por ocasionarem a diminuição da energia de ativação do processo, provendo rotas alternativas de reação menos energéticas, acelerando a reação entre o açúcar e o oxigênio.
e) As enzimas atuam como catalisadores da reação, por ocasionarem a diminuição da energia de ativação do processo ao inibirem a ação oxidante do oxigênio, desacelerando a reação entre o açúcar e o oxigênio.
8. (Fuvest 2014) Em um laboratório químico, um estudante encontrou quatro frascos (1, 2, 3 e 4) contendo soluções aquosas incolores de sacarose, KCl, HCl e NaOH, não necessariamente nessa ordem. Para identificar essas soluções, fez alguns experimentos simples, cujos resultados são apresentados na tabela a seguir:
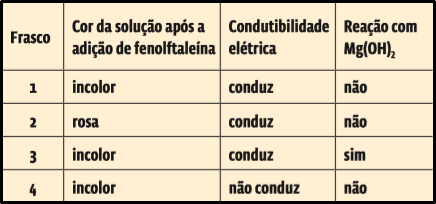
(Dado: Soluções aquosas contendo o indicador fenolftaleína são incolores em pH menor do que 8,5 e têm coloração rosa em pH igual a ou maior do que 8,5.)
As soluções aquosas contidas nos frascos 1, 2, 3 e 4 são, respectivamente, de
a) HCl, NaOH, KCl e sacarose.
b) KCl, NaOH, HCl e sacarose.
c) HCl, sacarose, NaOH e KCl
d) KCl, sacarose, HCl e NaOH.
e) NaOH, HCl, sacarose e KCl.
9. (UEM-PAS 2014, adaptado) Hoje a preocupação sobre poluição atmosférica está voltada ao poluente ozônio troposférico (O3), relacionado ao câncer, à pneumonia e à asma. Paulo Saldiva, do laboratório de poluição atmosférica da USP, afirma que os veículos melhoraram a queima e diminuíram a emissão de CO, entretanto o O3 ainda não está regulamentado. Para Saldiva, o comprador deve checar a emissão de hidrocarbonetos e óxidos nitrosos – que reagem e produzem O3 – se quiser um carro menos inimigo da natureza
Revista Galileu, Ed. Globo, agosto de 2012.
Dadas abaixo algumas reações químicas envolvidas na formação do O3 troposférico e com base no texto acima, analise as afirmações a seguir e marque V para verdadeiro e F para falso:
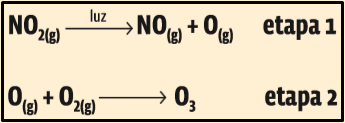
( ) O NO2 liberado na queima de combustíveis fósseis é precursor da formação de O3, e o O(g) é considerado um intermediário de reação.
( ) No ser humano, o ar penetra pelo nariz, passa pela faringe, pela laringe, pela traqueia, pelos brônquios e pelos bronquíolos. A asma alérgica, causada por inalação de O3 ou por outros poluentes, está relacionada a um processo inflamatório nos brônquios e nos bronquíolos.
( ) O NO2 é um poluente atmosférico que, além de auxiliar na formação de O3 troposférico, ainda pode gerar ácido nítrico na presença de água, causando chuvas ácidas.
( ) As reações de formação de O3 troposférico são favorecidas em cidades de clima quente, porque a elevação da temperatura propicia maior frequência de choques e com maior energia cinética entre as moléculas gasosas reagentes.
10. (UFSM 2014) Na produção de eletricidade são, algumas vezes, usados geradores a óleo. Quando o óleo queima, produz SO2, que deve ser eliminado antes de ser emitido ao ar, pois é formador de chuva ácida. Um dos métodos para a sua eliminação usa o calcário, produzindo sulfito de cálcio, que, posteriormente, é removido por precipitação eletrostática.
As reações envolvidas na eliminação do SO2 são:
1. CaCO3 → CaO(s) + CO2(g)
2. CaO(s) + SO2(g) → CaSO3(s)
As reações 1 e 2 denominam-se, respectivamente, reações de
a) deslocamento e análise.
b) deslocamento e síntese.
c) síntese e análise.
d) análise e síntese.
e) síntese e deslocamento.
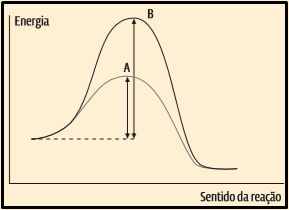
11. (Uema 2014, adaptada) A Fórmula Indy de automobilismo, realizada em Indianápolis, Estados Unidos, usa o metanol como combustível, que em combustão possui chama invisível. Por isso são comuns acidentes nos quais os pilotos se queimam sem que o fogo seja visto. Uma forma de obtenção desse composto pode ser reagir dióxido de carbono gasoso mais gás hidrogênio e utilizar como catalisador o CrO3 – ZnO (sólido branco e granular) numa temperatura na faixa de 320–380 °C e pressão de 340 atm. Considerando o exposto, identifique no gráfico a seguir a curva que representa a reação que utiliza um catalisador. Explique sua opção.
CAPÍTULO 3
12. (Enem 2014) Grandes fontes de emissão do gás dióxido de enxofre são as indústrias de extração de cobre e níquel, em decorrência da oxidação dos minérios sulfurados. Para evitar a liberação desses óxidos na atmosfera e a consequente formação da chuva ácida, o gás pode ser lavado, em um processo conhecido como dessulfurização, conforme mostrado na equação (1).
CaCO3(s) + SO2(g) → CaSO3(s) + CO2(g) (1)
Por sua vez, o sulfito de cálcio formado pode ser oxidado, com o auxílio do ar atmosférico, para a obtenção do sulfato de cálcio, como mostrado na equação (2). Essa etapa é de grande interesse porque o produto da reação, popularmente conhecido como gesso, é utilizado para fins agrícolas.
2 CaSO3(s) + O2(g) → 2 CaSO4(s) (2)
As massas molares dos elementos carbono, oxigênio, enxofre e cálcio são iguais a 12 g/mol, 16 g/mol, 32 g/mol e 40 g/mol, respectivamente.
BAIRD, C. Química ambiental. Porto Alegre: Bookman. 2002 (adaptado).
Considerando um rendimento de 90% no processo, a massa de gesso obtida, em gramas, por mol de gás retido é mais próxima de
a) 64
b) 108
c) 122
d) 136
e) 245
13. (Enem 2014) Diesel é uma mistura de hidrocarbonetos que também apresenta enxofre em sua composição. Esse enxofre é um componente indesejável, pois o trióxido de enxofre gerado é um dos grandes causadores da chuva ácida. Nos anos 1980, não havia regulamentação e era utilizado óleo diesel com 13 000 ppm de enxofre. Em 2009, o diesel passou a ter 1 800 ppm de enxofre (S1800) e, em seguida, foi inserido no mercado o diesel S500 (500 ppm). Em 2012, foi difundido o diesel S50, com 50 ppm de enxofre em sua composição. Atualmente, é produzido um diesel com teores de enxofre ainda menores.
Os Impactos da má qualidade do óleo diesel brasileiro. Disponível em: https://www.cnt.org.br.
Acesso em: 20 dez. 2012 (adaptado).
A substituição do diesel usado nos anos 1980 por aquele difundido em 2012 permitiu uma redução percentual de emissão de SO3 de:
a) 86,2%.
b) 96,2%.
c) 97,2%.
d) 99,6%.
e) 99,9%.
14. (Fuvest 2015) A grafite de um lápis tem quinze centímetros de comprimento e dois milímetros de espessura. Dentre os valores abaixo, o que mais se aproxima do número de átomos presentes nessa grafite é
Nota: Assuma que a grafite é um cilindro circular reto, feito de grafite pura. A espessura da grafite é o diâmetro da base do cilindro. Adote os valores aproximados de:
1. 2,2 g/cm3 para a densidade da grafite;
2. 12 g/mol para a massa molar do carbono;
3. 6,0 . 1023 mol–1 para a constante de Avogadro.
a) 5 x 1023
b) 1 x 1023
c) 5 x 1022
d) 1 x 1022
e) 5 x 1021
15. (Mackenzie 2014) A calcita é um mineral encontrado na forma de cristais e em uma grande variedade de formas, como também nas estalactites e estalagmites. É o principal constituinte dos calcários e mármores, ocorrendo também em conchas e rochas sedimentares. Pelo fato de ser composta por CaCO3, a calcita reage facilmente com HCl, formando cloreto de cálcio, gás carbônico e água. Considerando que uma amostra de 10 g de calcita, extraída de uma caverna, ao reagir com quantidade suficiente de HCl, produziu 1,792 L de gás carbônico, medido nas CNTP, é correto afirmar que essa amostra apresentava um teor de CaCO3 da ordem de (Dado: massa molar (g/mol) CaCO3 = 100)
a) 75%
b) 80%
c) 85%
d) 90%
e) 95%
16. (Enem 2013) A varfarina é um fármaco que diminui a agregação plaquetária, e por isso é utilizada como anticoagulante, desde que esteja presente no plasma, com uma concentração superior a 1,0 mg/L. Entretanto, concentrações plasmáticas superiores a 4,0 mg/L podem desencadear hemorragias. As moléculas desse fármaco ficam retidas no espaço intravascular e dissolvidas exclusivamente no plasma, que representa aproximadamente 60% do sangue em volume. Em um medicamento, a varfarina é administrada por via intravenosa na forma de solução aquosa, com concentração de 3,0 mg/mL. Um indivíduo adulto, com volume sanguíneo total de 5,0 L, será submetido a um tratamento com solução injetável desse medicamento. Qual é o máximo volume da solução do medicamento que pode ser administrado a esse indivíduo, pela via intravenosa, de maneira que não ocorram hemorragias causadas pelo anticoagulante?
a) 1,0 mL
b) 1,7 mL
c) 2,7 mL
d) 4,0 mL
e) 6,7 mL
CAPÍTULO 4
17. (Enem 2014)A revelação das chapas de raios X gera uma solução que contém íons prata na forma de Ag(SO2O3)23 –. Para evitar a descarga desse metal no ambiente, a recuperação de prata metálica pode ser feita tratando eletroquimicamente essa solução com uma espécie adequada. O quadro apresenta semirreações de redução de alguns íons metálicos.
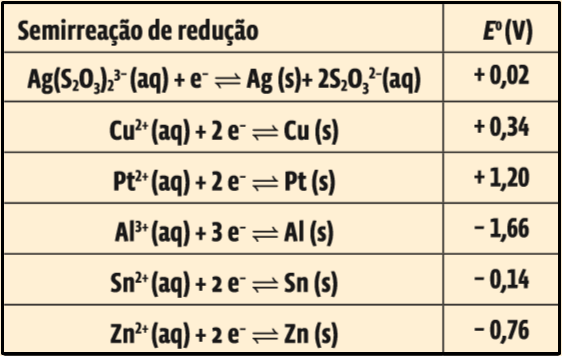
Das espécies apresentadas, a adequada para essa recuperação é
a) Cu (s).
b) Pt (s).
c) Al3+ (aq).
d) Sn (s).
e) Zn2+ (aq).
18. (Espcex/Aman) 2015) Uma pilha de zinco e prata pode ser montada com eletrodos de zinco e prata e representada, segundo a União Internacional de Química Pura e Aplicada (IUPAC), pela notação Zn(s) / Zn 2+ (aq) 1 mol.L–1 // Ag+ (aq) 1 mol.L–1 / Ag (s). As equações que representam as semirreações de cada espécie e os respectivos potenciais-padrão de redução (25 °C e 1 atm) são apresentadas a seguir:
Zn2+(aq) + 2e– → Zn(s) E0 = – 0,76 V
Ag+(aq) + 1e– → Ag(s) E0 = + 0,80 V
Com base nas informações apresentadas, são feitas as afirmativas abaixo.
I. No eletrodo de zinco ocorre o processo químico de oxidação.
II. O cátodo da pilha será o eletrodo de prata.
III. Ocorre o desgaste da placa de zinco devido ao processo químico de redução do zinco.
IV. O sentido espontâneo do processo será Zn+2 + 2 Ag0 → Zn0 + 2Ag+.
V. Entre os eletrodos de zinco e prata existe uma diferença de potencial-padrão
de 1,56 V.
Estão corretas apenas as afirmativas
a) I e III.
b) II, III e IV.
c) I, II e V.
d) III, IV e V.
e) IV e V.
19. (Espcex/Aman 2015) A meia-vida do radioisótopo cobre-64(6429Cu) é de apenas 12,8 horas, pois ele sofre decaimento se transformando em zinco, conforme a representação
![]()
Considerando uma amostra inicial de 128 mg de cobre-64, após 76,8 horas, a massa restante desse radioisótopo será de:
a) 2 mg
b) 10 mg
c) 12 mg
d) 28 mg
e) 54 mg
20. (PUC-Rio 2015) O metanol é um álcool utilizado como combustível em alguns tipos de competição automotiva, por exemplo, na Fórmula Indy. A queima completa (ver reação termoquímica abaixo) de 1L de metanol (densidade 0,80 g.mL–1) produz energia na forma de calor (em kJ) e CO2 (em gramas), nas seguintes quantidades respectivamente:
2 CH3OH(l) + 3 O2(g) → 4H2O(l) + 2CO2(g) ; ΔH = –1453 kJ
(Considere: M(CH3OH) = 32g mol–1 e M(CO2) = 44g mol–1 )
a) 18,2 x 103 e 1,1 x 103
b) 21,3 x 103 e 0,8 x 103
c) 21,3 x 103 e 1,1 x 103
d) 18,2 x 103 e 0,8 x 103
e) 36,4 x 103 e 1,8 x 103
21. (Unicamp 2014) Explosão e incêndio se combinaram no terminal marítimo de São Francisco do Sul, em Santa Catarina, espalhando muita fumaça pela cidade e pela região. O incidente ocorreu com uma carga de fertilizante em que se estima tenham sido decompostas 10 mil toneladas de nitrato de amônio. A fumaça branca que foi eliminada durante 4 dias era de composição complexa, mas apresentava principalmente os produtos da decomposição térmica do nitrato de amônio: monóxido de dinitrogênio e água. Em abril de 2013, um acidente semelhante ocorreu em West, Estados Unidos da América, envolvendo a mesma substância. Infelizmente, naquele caso, houve uma explosão, ocasionando a morte de muitas pessoas.
a) Com base nessas informações, escreva a equação química da decomposição térmica que ocorreu com o nitrato de amônio.
b) D ado que os valores das energias-padrão de formação em kJ.mol–1 das substâncias envolvidas são nitrato de amônio (–366), monóxido de dinitrogênio (82) e água (–242), o processo de decomposição ocorrido no incidente é endotérmico ou exotérmico? Justifique sua resposta considerando a decomposição em condições padrão.
CAPÍTULO 5
22. (Unifor 2014, adaptada) O dióxido de nitrogênio é um gás de cor castanho-avermelhada, de cheiro forte e irritante. É um agente oxidante forte e sua presença na atmosfera contribui para a formação de chuvas ácidas. Em um recipiente contendo apenas NO2, ocorre o seguinte processo a temperatura constante:
2NO2(g) ↔ 2NO(g) + O2(g)
As concentrações do reagente e dos produtos foram acompanhadas com o passar do tempo, conforme mostra o gráfico abaixo.
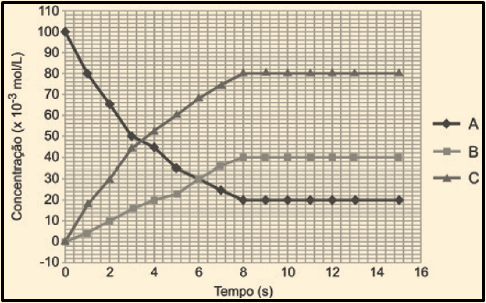
Analisando o gráfico, indique se a afirmação abaixo é verdadeira (V) ou falsa (F):
I. O aumento da pressão favorece a formação de NO(g) e O2(g).
II. Ao atingir o equilíbrio, a constante de equilíbrio terá valor de 640.
III. As curvas A, B e C representam respectivamente as concentrações de NO2, NO e O2.
IV. A partir de 6s o sistema atinge o equilíbrio e não ocorre alteração nas concentrações.
V. O aumento da pressão favorece o deslocamento da reação no sentido do NO2(g).
23. (Fuvest 2015) A Gruta do Lago Azul (MS), uma caverna composta por um lago e várias salas, em que se encontram espeleotemas de origem carbonática (estalactites e estalagmites), é uma importante atração turística. O número de visitantes, entretanto, é controlado, não ultrapassando 300 por dia. Um estudante, ao tentar explicar tal restrição, levantou as seguintes hipóteses:
I. Os detritos deixados indevidamente pelos visitantes se decompõem, liberando metano, que pode oxidar os espeleotemas.
II. O aumento da concentração de gás carbônico que é liberado na respiração dos visitantes, e que interage com a água do ambiente, pode provocar a dissolução progressiva dos espeleotemas.
III. A concentração de oxigênio no ar diminui nos períodos de visita, e essa diminuição seria compensada pela liberação de O2 pelos espeleotemas.
O controle do número de visitantes, do ponto de vista da química, é explicado por
a) I, apenas.
b) II, apenas.
c) III, apenas.
d) I e III, apenas.
e) I, II e III.
24. (UEL 2014, adaptada) O fenômeno chamado Smog Fotoquímico é catalisado por luz solar e é reconhecido como um conjunto de reações químicas que ocorrem nas atmosferas das regiões metropolitanas. Os reagentes originais mais importantes nas ocorrências do Smog Fotoquímico são o óxido nítrico ( NOx), os hidrocarbonetos e os compostos orgânicos voláteis (COvs), que são poluentes emitidos no ar, provenientes da queima incompleta dos motores de combustão interna e de outras fontes. A reação desses compostos na presença de luz solar é apresentada a seguir.
COvs + NOx + O2 + luz solar → mistura de O3, HNO3, compostos orgânicos. Como se observa, um dos produtos da reação do Smog Fotoquímico é o HNO3, que pode contribuir para a formação de chuva ácida. O uso de catalisadores metálicos colocados no sistema de exaustão de veículos movidos a gasolina, antes do tubo de escape, contribui para a redução da emissão de NOx. Com base no texto e levando em conta que o HNO3 é o produto formado, considere as afirmativas a seguir.
I. Se uma amostra de 100,00 mL de chuva ácida tem pH 4,00, o volume de solução de NaOH 0,01 mol/L para consumir o ácido é de 1,00 mL.
II. A precipitação de chuvas ácidas é capaz de dissolver o alumínio na forma de Al(OH)3 retido em sedimentos e rochas.
III. A precipitação de chuvas ácidas em solos contendo CaCO3 aumenta o pH do solo.
Assinale a alternativa correta.
a) Somente as afirmativas I e II são corretas.
b) Somente as afirmativas I e III são corretas.
c) Somente as afirmativas II e III são corretas.
d) Todas as afirmativas são corretas.
e) Todas as afirmativas são incorretas.
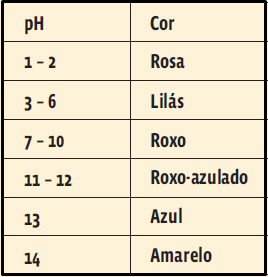
25. (UEMG 2014) O potencial hidrogeniônico (pH) é uma medida de acidez presente nos mais diversos sistemas químicos, sejam eles orgânicos ou não. A figura a seguir mostra alguns valores de pH encontrados em quatro partes do corpo humano, a 25 °C.
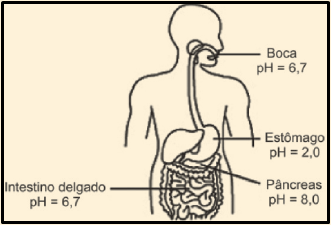
Com base nos sistemas dados (boca, estômago, pâncreas e intestino delgado) e nas informações fornecidas, é correto afirmar que
a) a acidez no estômago é decorrente da produção do ácido sulfúrico.
b) a boca é tão alcalina quanto o intestino delgado.
c) no intestino delgado, a concentração de íons hidrogênio é igual a 6,7 mol/L.
d) o estômago é cerca de 1 milhão (106) de vezes mais ácido que o pâncreas.
26. (UFG 2014, adaptada) O extrato de amora pode funcionar como um indicador natural de pH, apresentando diferentes colorações de acordo com o caráter ácido ou alcalino das soluções, conforme demonstrado na tabela a seguir. A partir da tabela abaixo, calcule
a) o pH e indique a cor de uma solução de Ca(OH)2 preparada na concentração de 0,050 mol . L–1 na presença do indicador natural;
b) o pH e indique a cor resultante após a mistura de 10 mL de Ca(OH)2 na concentração de 0,100 mol . L–1 com 30 mL de H2SO4 a 0,100 mol . L–1 , na presença do indicador natural.
CAPÍTULO 6
27. (PUCPR 2015, adaptada) O poliestireno (PS) é um polímero muito utilizado na fabricação de recipientes de plásticos, tais como: copos e pratos descartáveis, pentes, equipamentos de laboratório, partes internas de geladeiras, além do isopor (poliestireno expandido). Este polímero é obtido na polimerização por adição do estireno (vinilbenzeno). A estrutura desse monômero é:
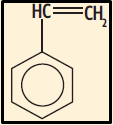
A cadeia carbônica deste monômero é classificada como:
a) Normal, insaturada, homogênea e aromática.
b) Ramificada, insaturada, homogênea e aromática.
c) Ramificada, saturada, homogênea e aromática.
d) Ramificada, insaturada, heterogênea e aromática.
e) Normal, saturada, heterogênea e alifática.
28. (Enem 2014, adaptada) A talidomida é um sedativo leve e foi muito utilizado no tratamento de náuseas, comuns no início da gravidez. Quando foi lançada, era considerada segura para o uso de grávidas, sendo administrada como uma mistura racêmica composta pelos seus dois enantiômeros (R e S). Entretanto, não se sabia, na época, que
o isômero óptico S leva à malformação congênita, afetando principalmente o desenvolvimento normal dos braços e pernas do bebê.
COELHO, F. A. S. “Fármacos e quiralídade”. Cadernos Temáticos de Química Nova na Escola, São Paulo, n. 3, maio 2001 (adaptado).
Essa malformação congênita ocorre porque esses isômeros ópticos
a) reagem entre si.
b) não podem ser separados.
c) não estão presentes em partes iguais.
d) interagem de maneira distinta com o organismo.
e) são estruturas com diferentes grupos funcionais.
29. (Enem 2014) A capacidade de limpeza e a eficiência de um sabão dependem de sua propriedade de formar micelas estáveis, que arrastam com facilidade as moléculas impregnadas no material a ser limpo. Tais micelas têm em sua estrutura partes capazes de interagir com substâncias polares, como a água, e partes que podem interagir com substâncias apolares, como as gorduras e os óleos.
SANTOS, W. L. P; MOL, G. S. (Coords.). Química e sociedade.
São Paulo: Nova Geração, 2005 (adaptado).
A substância capaz de formar as estruturas mencionadas é
a) C18H36
b) C17H33COONa.
c) CH3CH2COONa.
d) CH3CH2CH2COOH.
e) CH3CH2CH2CH2OCH2CH2CH2CH3
30. (Uerj 2015) A vanilina é a substância responsável pelo aroma de baunilha presente na composição de determinados vinhos. Esse aroma se reduz, porém, à medida que a vanilina reage com o ácido etanoico, de acordo com a equação química abaixo.
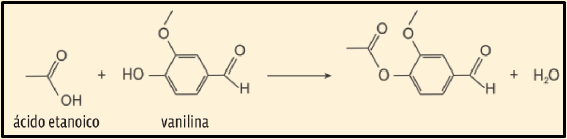
A substância orgânica produzida nessa reação altera o aroma do vinho, pois apresenta um novo grupamento pertencente à função química denominada:
a) éster
b) álcool
c) cetona
d) aldeído
31. (PUCRS 2014) Analise as informações a seguir.
Em 2001, algumas indústrias brasileiras começaram a abolir voluntariamente o uso dos plastificantes ftalatos em brinquedos e mordedores, entre muitos outros itens fabricados em PVC flexível destinados à primeira infância, pois os ftalatos causam uma série de problemas à saúde, incluindo danos ao fígado, aos rins e aos pulmões, bem como anormalidades no sistema reprodutivo e no desenvolvimento sexual, sendo classificados como prováveis carcinogênicos humanos. A fórmula a seguir representa a estrutura do dibutilftalato, principal substância identificada nas amostras estudadas, que pode causar esses efeitos irreversíveis muito graves quando inalado, ingerido ou posto em contato com a pele.
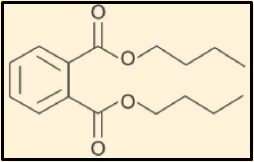
Em relação ao dibutilftalato, é correto afirmar que é um composto orgânico
a) da função dos éteres.
b) de cadeia alifática.
c) de fórmula molecular C16H22O4
d) de elevada solubilidade em água.
e) de isomeria cis-trans.
32. (Espcex/Aman 2015) A aspirina foi um dos primeiros medicamentos sintéticos desenvolvidos e ainda é um dos fármacos mais consumidos no mundo. Contém como princípio ativo o ácido acetilsalicílico (AAS), um analgésico e antipirético, de fórmula estrutural plana simplificada mostrada abaixo:
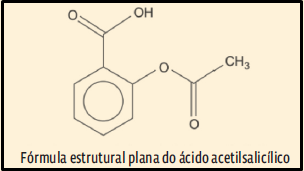
Considerando a fórmula estrutural plana simplificada do AAS, a alternativa que apresenta corretamente a fórmula molecular do composto e os grupos funcionais orgânicos presentes na estrutura é:
a) C9H8O4 ; amina e ácido carboxílico.
b) C10H8O4 ; éster e ácido carboxílico.
c) C9H4O4 ; ácido carboxílico e éter.
d) C10H8O4 ; éster e álcool.
e) C9H8O4 ; éster e ácido carboxílico.









