Química: Simulado (Resposta)
CAPÍTULO 1
1. Para a primeira parte da questão: dos metais presentes nas substâncias (cálcio, chumbo, estrôncio, magnésio, manganês, ferro e bário), os metais Ca, Sr, Mg e Ba pertencem à segunda coluna da tabela periódica e, portanto, têm apenas 2 elétrons na camada de valência. Considerando os números atômicos dos metais restantes (25Mn, 26Fe e 82Pb) verificamos que o único que corresponde à exigência de possuir 4 elétrons na camada de valência seria o chumbo, assim teremos:
![]()
A camada mais externa (camada de valência) do Pb será: 6s26p2 . Portanto, o mineral cujo metal no estado fundamental tem quatro elétrons na camada de valência é a cerussita.
Para a segunda parte da questão: que o raio cresce quanto menor for o número de prótons (que define o número atômico). Isso porque quanto menos prótons um elemento tem, menor é o poder de atração do núcleo (carga positiva) sobre os elétrons (carga negativa). Além disso, o raio aumenta, também, com o número de camadas eletrônicas. Assim, na tabela periódica, temos:
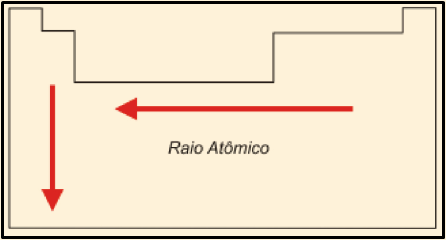
Dentre os metais citados na questão, Ca, Sr, Mg, Ba e Pb, o Ba tem maior raio, pela junção dos dois fatores. Portanto, a fórmula química da substância que contém o metal de maior raio é BaCO3.
2. Você se lembra: densidade é a relação entre massa e volume ( d = m/V).
Com os dados oferecidos no enunciado, é possível calcular as densidades das diferentes marcas de creme dental.
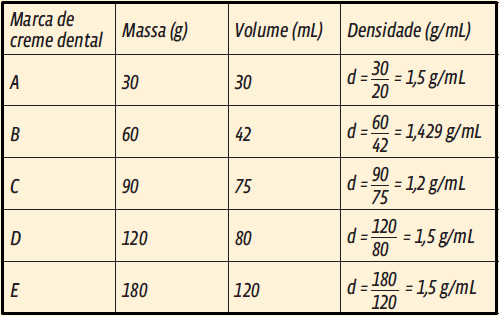
Sabemos que, quanto maior for a proporção de água, menor será a densidade da solução. Então, a marca C apresenta a maior porcentagem de água.
3. A questão exige que você saiba ler as informações sobre um elemento químico, interpretando os números que aparecem acima e abaixo do símbolo:
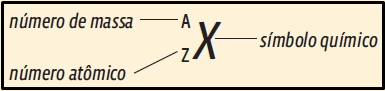
Você deve, também, saber o significado de alguns termos:
• Número atômico (Z) é o número de prótons;
• Número de massa (A) é a soma de prótons e nêutrons (A = Z + N);
• Isóbaros são átomos de mesmo número de massa.
Analisando cada alternativa:
a) A = Z + N. Então N = A – Z.
• Para I, temos: N = 137 – 53 = 84 nêutrons;
• Para Cs termos: N = 137 – 55 = 82 nêutrons.
Falsa.
b) Sim, ambos os elementos apresentam A = 137. Verdadeira.
c) Para I, Z = 53; para Cs, Z = 55. Falsa.
d) A água (H2O) é uma substância pura composta, pois apresenta dois elementos em sua composição: hidrogênio e oxigênio. Falsa.
e) Já vimos na alternativa b que Cs e I têm o mesmo número de massa (A).
Resposta: B
4. A questão pede que você conheça um pouco da história da química, no caso, o desenvolvimento dos modelos atômicos. Os primeiros modelos atômicos foram imaginados por filósofos da Antiguidade, como Demócrito. Mas os normalmente citados nas aulas e exames são os desenvolvidos no século XIX e início do XX. Cronologicamente, o primeiro modelo foi o de Dalton: o átomo é uma esfera semelhante a uma bola de bilhar, maciça e indivisível. O segundo, o de Thomson: o átomo não é indivisível, mas composto de partículas menores. O modelo descrevia uma esfera maciça de carga positiva pontilhada por partículas de carga negativa (pudim de passas). O último modelo, de Rutherfor-Börh no início do século XX, é o mais aceito hoje: um núcleo denso (carga positiva) rodeado por uma nuvem de elétrons (carga negativa). O desenho clássico do modelo Rutherfor-Böhr é semelhante a um minissistema solar.
Resposta: A
5. A questão fala em propriedades químicas e, principalmente, físicas. E você pode respondê-la apenas se lembrando de objetos fabricados no dia a dia. Repare, apenas, que as propriedades, na questão, são citadas duas a duas. Mas vamos analisar cada uma das propriedades citadas. Veja na tabela abaixo:
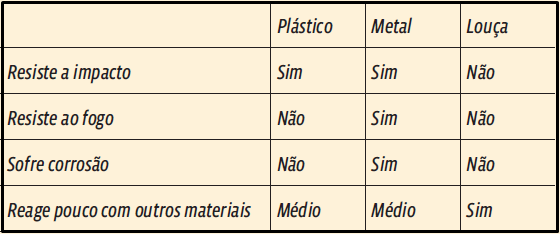
Resposta: E
CAPÍTULO 2
6. Analisando cada uma das alternativas:
• Falsa. Aumento de temperatura e na concentração dos reagentes acelera uma reação;
• Verdadeira. Para que uma reação ocorra, as moléculas devem se chocar numa orientação favorável e o sistema deve atingir a energia de efetivação;
• Verdadeira. Com pouco oxigênio, a combustão cessa e a vela se apaga;
• Falsa. Quanto maior a superfície de contato, maior a velocidade da reação (o que implica menor tempo de reação).
7. Aqui você deve se lembrar de alguns conceitos de cinética química:
• Energia de ativação é a energia necessária para que uma reação se inicie. Quanto menor for a energia de ativação, mais rápida é uma reação;
• Colisão efetiva é aquela que ocorre quando átomos, íons ou moléculas se chocam a uma velocidade adequada e, também, numa orientação que coloque em contato átomos capazes de estabelecer as novas ligações químicas;
• Catalisadores, como as enzimas, são substâncias que aumentam a velocidade de uma reação, baixando a energia de ativação;
• Inibidores, ao contrário, reduzem a velocidade de uma reação porque baixam a energia de ativação.
Resposta: D
8. Para responder corretamente à questão, você precisa se lembrar dos conceitos de ácido, base e sal.
Lembrando:
• Ácidos são substâncias que, puras, não conduzem eletricidade. Mas, dissolvidos em água, produzem cátions de hidrogênio (H+), bons condutores;
• Bases são substâncias que contêm o ânion (OH–). Dissolvidas em água, esse íon se dissocia de seu cátion, e a solução se torna condutora de eletricidade;
• O pH é a escala de acidez de uma solução. Valores de pH menores que 7 são ácidas; iguais a 7, neutras; e acima de 7, básicas.
• Compostos moleculares são formados apenas por ligações covalentes, ou seja, não possuem íons (veja o capítulo 1).
Analisando a tabela:
• Frasco 1: ocorre condução de eletricidade, não ocorre reação com hidróxido de magnésio e a solução não apresenta pH igual ou maior do que 8,5. Portanto, a solução é de cloreto de potássio (KCl) ;
• Frasco 2: é o único que tem coloração rosa e, portanto, o único que apresenta pH igual ou maior do que 8,5. Isso significa que seu conteúdo é uma base. A única base entre as substâncias apresentadas é NaOH;
• Frasco 3: ocorre reação com Mg (OH)2 que é uma base. Para reagir com uma base, a outra substância deve ser um ácido (reação de neutralização) – neste caso, HCl.
• Frasco 4: não ocorre condução de eletricidade, conclui-se que a solução é um composto molecular, a sacarose.
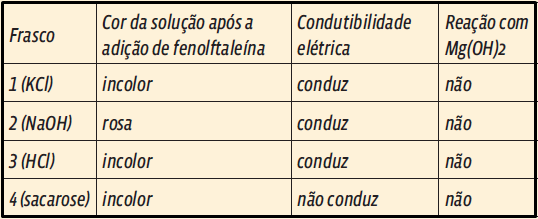
Resposta: B
9. Verdadeiro. Conforme as etapas de formação de ozônio, percebe-se que o NO2 liberado na queima de combustíveis fósseis é quebrado pela ação da luz, liberando O(g). Esse átomo de oxigênio, por sua vez, reage com a molécula O2(g) do ar, produzindo O3. Portanto, o O(g) é considerado um intermediário de reação. Verdadeiro. A sequência de órgãos do sistema respiratório está correta. A asma alérgica é uma inflamação nos brônquios e nos bronquíolos, e esse processo pode ser desencadeado por O3, e também por outras substâncias, como pólen ou poeira. Verdadeiro. O NO2 é um óxido molecular, poluente da atmosfera. Além de ajudar na formação de O3 troposférico, e, na presença de água, pode gerar o ácido nítrico (HNO3), responsável pelas chuvas ácidas. A sequência de reações é a seguinte:
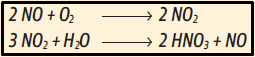
Verdadeiro. As reações de formação de O3 são favorecidas em cidades de clima quente, porque a elevação da temperatura aumenta a frequência de choques entre as moléculas reagentes.
10. Analisando cada uma das reações:
1. CaCO3 → CaO(s) + CO2(g)
Um composto se separa em substâncias mais simples: reação de análise ou decomposição.
2. CaO(s) + SO2(s) → CasO3(s)
Duas substâncias simples se unem em um único produto: reação de síntese.
Resposta: D
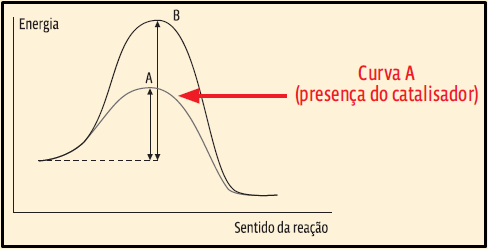
11. Você deve se lembrar de que, na presença de um catalisador, a energia de ativação diminui, acelerando a reação. Portanto, a curva A é a que se refere à reação em que ocorre catálise.
CAPÍTULO 3
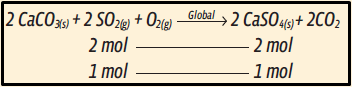
12. Antes de mais nada, compreenda bem o enunciado. A formação do gesso (CasO4) a partir do dióxido de enxofre (SO2) acontece por etapas: primeiro, uma reação consome o SO2 e forma o sulfito de cálcio (CasO3), depois, este será consumido na segunda etapa, na qual se forma o gesso (CasO4). Encontrando a reação global, temos
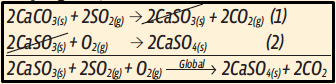
Repare que, para cada 2 mol de gesso (CasO4), foram necessários 2 mol de SO2. Então a reação de cada mol de SO2 resulta em 1 mol de gesso.
Mas, se o processo tem rendimento de 90%, serão produzidos, na realidade, 0,9 mol. Resta calcular a massa de 0,9 mol de gesso. Para isso, usamos a massa molar de CasO4:
1 Ca = 1 . 40 = 40
1 s = 1 . 32 = 32
4 O = 4 . 16 = 64
Massa a molar do CasO4 = 136 g/mol
Para chegar aos 90%, fazemos 136 g . 0,9 = 122,4 g.
Assim, a massa de gesso obtida para cada mol de SO2 retido num processo com 90% de rendimento é de 122,4 g.
Resposta: C
13. Esta questão exige mais habilidades matemáticas do que químicas: pede um cálculo simples de porcentagem.
Em 2008 eram 13 000 ppm; em 2012, 50 ppm.
Entre os dois anos, a redução foi de 13 000 – 50 = 12 950 ppm.
A regra de três para a porcentagem reduzida no período:
13 000 ———- 100%
12 950 ———- x%
x = 99,6%
Resposta: D
14. Novamente, habilidades matemáticas associadas a conhecimentos de química. Primeiro, é preciso calcular o volume do cilindro de grafite:
Vcilindro = Área da base . Altura
Vcilindro = π . r2 . h → Vcilindro = π . (10–1)2 . 15
Vcilindro = 0,472 cm3
O enunciado fornece a densidade da grafite, poderemos calcular a massa do cilindro (massa de grafite): 2,2 g/cm3. Por regra de três, temos
2,2 g ——- 1 cm3
m ———- 0,471 cm3
m = 1,0362 g
A partir daqui entra a química. Você deve saber que a grafite é formada somente por átomos de carbono (C). O enunciado dá a massa molar do C: 12 g/mol. Para calcular o número de átomos em 1 mol, usamos a constante de Avogadro, 6,0 . 1023 mol–1.
O resultado vem de nova regrinha de três:
12 g ———- 6,0 . 1023 átomos
1,0362 g —— x átomos
x = 5,18 . 1022 átomos
Resposta: C
15. Segundo o enunciado, o CaCO3 constitui apenas parte do mineral calcita. O problema pede a proporção de CaCO3 em 10 g do mineral. E nos fornece o volume de CO2 produzido na reação desse composto com HCl. Com isso, montamos e balanceamos a equação:
CaCO3 + 2HCl → 2H2O + CO2 + CaCl2
A equação balanceada fornece as proporções, em mol, dos reagentes e produtos:
CaCO3 + 2HCl → 2H2O + CO2 + CaCl2
1 mol 2 mol 2 mol 1 mol 1 mol
Conhecendo a massa molar do CaCO3 e sabendo que qualquer gás nas CNTP ocupa um volume de 22,4 L, encontramos a massa de CaCO3 na amostra de calcita:
CaCO3 + 2HCl → 2H2O + CO2 + CaCl2
100 g —— 22,4 L
m ———- 1,792 L
m = 8 g
Outra regra de três dá o teor:
10 g ———- 100%
8 g ———- x%
x = 80%
Resposta: B
16. Esta é mais uma questão que exige habilidades químicas associadas a matemáticas. As moléculas do fármaco se dissolvem exclusivamente no plasma, que representa aproximadamente 60% do volume de sangue de um indivíduo. O adulto apresentado no enunciado tem volume sanguíneo total de 5,0 L. Encontramos, então, o volume de plasma correspondente a esses 60%:
5,0 L ———- 100%
Vplasma ———- 60%
Vplasma = 3 L
Acima de uma concentração de 4,0 mg/L o fármaco desencadeia hemorragias. portanto, esta seria a concentração máxima do medicamento. Conhecendo o volume de plasma (3 L) no paciente, descobrimos a quantidade máxima de varfarina que ele pode receber:
4 mg de varfarina ——- 1 L de plasma
m de varfarina ———- 3 L de plasma
m de varfarina = 12 mg
O cálculo final é para encontrar o volume máximo do fármaco que pode ser administrado ao paciente. Sabemos que a solução aquosa tem concentração do medicamento de 3,0 mg/mL. E que para 3 L de plasma, o máximo de varfarina indicado é de 12 mg. Portanto,
3 mg de varfarina ———- 1 mL de solução
12 mg de varfarina ——— Vmáximo de solução
Vmáximo = 4 mL
Resposta: D
CAPÍTULO 4
17. A questão pede conhecimento sobre reações de redução. Você se lembra que E0 apresentado na tabela é o potencial-padrão de redução de uma espécie – a medida, em volt, da tendência que a espécie tem de receber elétrons.
A reação de redução de Ag(SO2O3)23– é esta:
Ag(SO2O3)23– (aq) + e– → Ag(s) + 2 S2O32– (aq)
A essa reação, corresponde uma de oxidação da outra espécie, que doa os elétrons:
X(s) → X+ (aq) + e–
A espécie adequada pedida na questão é aquela que apresenta potencial de redução menor que a redução de Ag(2 S2O2)23–, que é de + 0,02 V. Temos três opções:
Al3+(aq) + 3 e– ↔ Al(s) (Eo = – 1,66 V)
Sn2+(aq) + 2 e– ↔ Sn(s) (Eo = – 0,14 V)
Zn2+(aq) + 2 e– ↔ Zn(s) (Eo = – 0,76 V)
Repare que as semirreações apresentadas são de redução. Portanto, os metais Al, Sn e Zn resultantes dessas semirreações podem sofrer oxidação. De todas as espécies apresentadas no enunciado, são estas as adequadas para a recuperação.
Resposta: D
18. Analisando cada uma das alternativas:
I. Verdadeiro. Das duas substâncias, Zn2+(aq) tem o menor potencial de redução e, portanto, sofre oxidação.
II. Verdadeiro. O polo positivo é chamado de catodo e é o eletrodo onde ocorre a redução.
III. Falso. O zinco sofre oxidação e não redução, por isso a sua placa sofre desgaste.
IV. Falso. Primeiro, entenda: o índice zero em Ag0 e Zn0 informa que se trata aqui dos metais Ag e Zn, eletricamente neutros, e não de seus íons. Em uma pilha, a espécie com maior potencial de redução sofre redução, enquanto a outra, oxidação. Das duas substâncias, Zn2+(aq) tem o menor potencial de redução e, portanto, sofre oxidação. E a prata sofre redução. Assim, encontramos a equação global:

Lembre que as pilhas funcionam por reações espontâneas e apresentam sempre um ΔE0 > 0. (veja no capítulo 4). Portanto, no sentido espontâneo da reação, temos
![]()
V. Verdadeiro. Para calcular o diferencial de potencial-padrão, consideramos que Δ E0 = E0redução + E0oxidação. Daí que ΔE0 = 0,8 + 0,76 = + 1,56V
Resposta: C
19. A questão exige apenas que você conheça o conceito de meia-vida. Meia-vida de um radioisótopo é o tempo necessário para a desintegração de metade dos átomos existentes em uma amostra desse isótopo, qualquer seja a massa da amostra. A meia-vida do radioisótopo de cobre-64 é de 12,8 horas. Isso significa que, a cada 12,8 horas, qualquer quantidade desse radioisótopo cai pela metade. A questão pede a quantidade depois de um período maior que 1 meia-vida. Então, encontramos a quantas meias-vidas correspondem as 76,8 horas e, depois, seguindo cada período de meia-vida, chegamos à resposta:

Resposta: A
20. A questão pede o cálculo da energia produzida por 1 L de metanol e, para tanto, precisamos calcular a massa de metanol que corresponde a volume. Conhecemos a densidade, então
0,8 g de metanol ——— 1 mL de metanol
m ——— 1000 mL (1 L) de metanol
m = 800 g de metanol
Pela equação termoquímica apresentada no enunciado, sabemos que a queima de 2 mol de metanol libera 1 453 kJ. E, conhecendo a massa molar do metanol, determinamos a variação de entalpia dessa queima:
2 mol = 64 g ——— libera 1453 kJ
800 g ——— ΔH
ΔH = 18 162 kJ = 18,2 x 103 kJ
Ainda utilizando a equação balanceada, podemos calcular a massa de CO2 utilizando, novamente, a regra de três. Sabemos que 2 mol de metanol resultam em 2 mol de CO2. Portanto,
64 g de metanol ———– 88 g de CO2
800 g de metanol ——— m
m = 1 100 g = 1,1 x 103 g
Resposta: A
21. a) Você deve associar o nome à fórmula de cada uma das substâncias inorgânicas citadas:
• nitrato de amônio: NH4NO3;
• monóxido de dinitrogênio: N2O.
É preciso, também, atenção na leitura do enunciado. A decomposição do nitrato de amônio é descrita assim: “os produtos da decomposição térmica do nitrato de amônio: monóxido de dinitrogênio e água”. Assim, identificamos que NH4NO3 é o reagente e o monóxido de dinitrogênio N2O e a água H2O são os produtos. Agora é só montar e balancear a equação química:
![]()
b) Você tem de se lembrar: exotérmica é a reação que libera energia térmica. Portanto, a variação da entalpia dos produtos é menor que a dos reagentes:
ΔH = Hprodutos – Hreagentes < 0.
Ao contrário, endotérmica é a reação que absorve energia na forma de calor.
Portanto, a variação da entalpia dos produtos é maior que a dos reagentes:
ΔH = Hprodutos – Hreagentes > 0.
O enunciado fornece a energia-padrão de formação de cada um dos compostos.
Então, na equação, temos:
![]()
– 366 kJ + 82 kJ 2(–242) kJ
ΔH = Hprodutos – Hreagentes
ΔH = [+ 82 kJ + 2(–242) kJ] – [–366 kJ]
ΔH = –36 kJ
ΔH < 0 ⇒ o processo de decomposição é exotérmico.
CAPÍTULO 5
22. Pela notação (seta em dois sentidos) apresentada no enunciado, a reação é reversível. Vamos entender o gráfico:
• As curvas representam a evolução da reação ao longo do tempo, medindo a concentração de cada uma das substâncias ao longo do tempo;
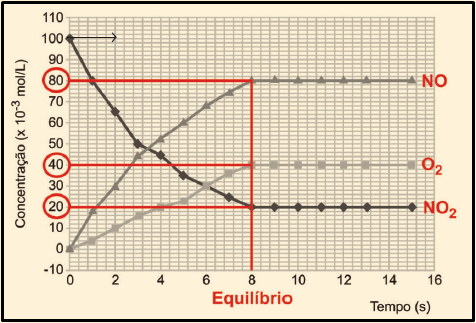
• Identificando o reagente: numa reação, você sabe, quanto maior a concentração de produtos, menor é a concentração de reagentes. A curva correspondente a A é a única cuja concentração cai. Daí que A é o reagente – 2NO2(g). Então, B e C correspondem aos produtos.
• Identificando cada um dos produtos: observe no gráfico que, depois de determinado tempo, a quantidade formada de C é o dobro da quantidade de B. Veja:
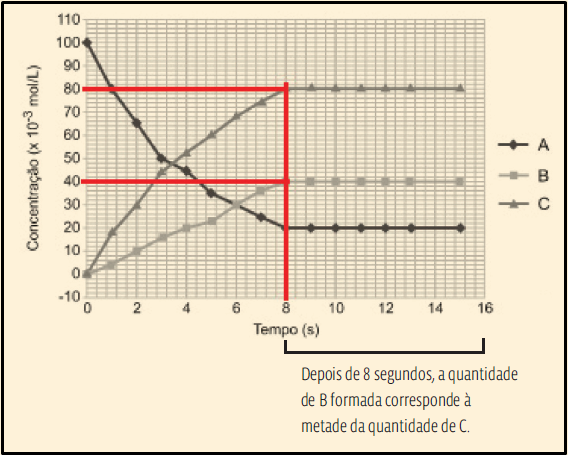
• Essa diferença de quantidade está relacionada às proporções estequiométricas de B e C na reação. Para 1 mol de B que se forma, formam-se 2 mol de C. Por fim, relacionando essa proporção com as quantidades apresentadas na equação química do enunciado, concluímos que C e B correspondem aos produtos 2NO(g) e O2(g), respectivamente.
Além disso, esta é a reação direta. Vamos às alternativas:
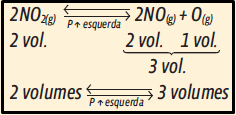
I. Incorreta. Um aumento na pressão desloca o equilíbrio no sentido da contração de volume, ou seja, no sentido que produz menor número de mol. Observando a reação, você verifica que o aumento da pressão favorecerá a reação inversa (formação de NO2). Deslocará o equilíbrio para a esquerda.
II. Incorreta. Do gráfico calculamos a constante de equilíbrio:
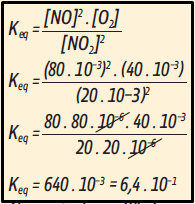
No ponto de equilíbrio, a constante de equilíbrio vale 6,4 . 10–1, que é o mesmo que 640 . 10–3.
III. Incorreta. Como vimos no início da resolução, as curvas A, B e C representam respectivamente as concentrações de NO2, O2 e NO.
IV. Incorreta. O sistema atinge o equilíbrio quando as velocidades das reações direta e inversa se igualam. E isso acontece quando as concentrações dos reagentes e dos produtos não mais se alteram. No gráfico, vemos que isso acontece aos 8 segundos.
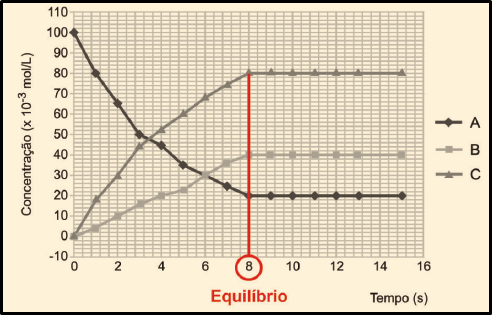
V. Correta. Como já vimos na análise da alternativa I, o aumento da pressão deslocará o equilíbrio no sentido da formação de NO2.
23. Analisando as afirmações:
I. Incorreta. Você deve se lembrar de que o carbonato de cálcio é o principal constituinte do mármore, da casca do ovo e de corais. É um sal que reage com ácidos, provocando a corrosão.
II. Correta. O gás carbônico é um óxido molecular (veja no capítulo 2), que na presença de água produz ácido carbônico. E o carbonato de cálcio reage com esse ácido, conforme a reação
CaSO3(s) + H2O(l) + CO2(g) → Ca2+(aq) + 2HCO3–(aq)
O aumento da concentração de gás carbônico (liberado na respiração dos visitantes), aumenta a quantidade do ácido carbônico produzido – o que aumenta a corrosão dos espeleotemas.
III. Incorreta. Verificando a reação no item II, vemos que a concentração de gás oxigênio não deslocará o equilíbrio químico. Portanto, não haverá deslocamento do equilíbrio químico, nem favorecendo e nem desfavorecendo a reação.
Resposta: B
24. I. Correta. Do enunciado temos que o volume de chuva analisada é de 100 mL e seu pH é 4,0. Você deve saber que pH = − log [H+]. O valor do pH é o expoente negativo da concentração de H+, portanto a [H+] = 10−4 mol/L. Aplicando a regra de três, descobrimos a quantidade de H+ que há na amostra:
1,0 . 10–4 mol —— 1000 mL
[H+] —— 100 mL
[H+] = 1,0 . 10–5 mol
Para neutralizar cada H+ é necessário um OH– (H+ + OH– → H2O), ou seja, serão necessários 10–5 mol de OH– para neutralizar o ácido presente nessa amostra de chuva. Sabendo que a solução de NaOH utilizada é 0,01 mol/L, calculamos a quantidade de OH– em 1 mL dessa solução por uma nova regra de três:
[OH–]:
0,01 mol —— 1000 mL
n —— 100 mL
n = 1 . 10–5 mol
Portanto, 1,0 mL de NaOH consome a quantidade de ácido citada na alternativa.
II. Correta. A solução de HNO3 na água da chuva ácida contém íons H+, que reagem com OH– do hidróxido de alumínio, em uma reação de neutralização. Essa reação diminui a concentração de OH–, que é consumido pelo ácido. Isso provoca o deslocamento do equilíbrio químico, favorecendo a diluição do hidróxido de alumínio, conforme a reação
Al(OH)3 ↔ Al3+(aq) + 3OH–(aq)
III. Incorreta. A chuva, por ser ácida, diminui o pH do solo.
Resposta: A
25. Analisando cada uma das alternativas:
a) Incorreta. Você deve se lembrar de alguns conceitos básicos de biologia: o ácido presente (formado) no estômago é o ácido clorídrico e não o ácido sulfúrico.
b) Incorreta. Observe que, tanto na boca quanto no intestino delgado, o pH = 6,7. Lembrando da escala de pH, você sabe que valores abaixo de 7,0 indicam meio ácido. Portanto, esse valor de pH não é de substância alcalina, mas ácida.
C) Incorreta. Lembrando-se da escala de pH, pH = − log [H+]. Assim, a concentração de H+ no intestino delgado é de 10−6,7 mol/L
D) Correta. Você deve se lembrar que pH = − log [H+]. O enunciado indica que no estômago o pH = 2 e, portanto a concentração de H+ = 10−2 mol/L. Já no pâncreas o pH = 8 e, portanto a [H+]= 10−8 mol/L. A concentração de H+ no estômago é , portanto, 1 milhão de vezes maior que no pâncreas: 10−8/10−2 = 106.
Resolução: D
26. a) Para a solução de Ca(OH)2:
Na dissociação do Ca(OH)2 a quantidade formada de OH− é:
Ca(OH)2 → Ca2+ + 2OH–
0,050 mol/L —— 2 . 0,05 mol/L = 0,10 mol/L
Conhecendo a concentração de OH−, calculamos o pOH da solução:
[OH–] = 0,10 mol/L
pOH = – log 10–1 = 1
Sabendo que, pH + pOH = 14 e que o pOH da solução é igual a 1, concluímos que o pH desta solução é 13. A cor da solução para esse valor de pH, na tabela, é o azul.
b) O enunciado pede que trabalhemos com a mistura de 10 ml de Ca(OH)2 0,100 mol/L–1 com 30 mL de H2SO4 0,100 mol/L–1 :
Lembre-se que a mistura de uma base, como Ca(OH)2, com um ácido, como H2SO4, provoca uma reação de neutralização com a formação de um sal e água. Vamos equacionar essa reação:
Ca(OH)2 + H2SO4 → CaSO4 + 2 H2O.
Da equação obtemos a proporção, em mol, de reagentes e produtos:
1 mol de Ca(OH)2 é neutralizado por 1 mol de H2SO4.
Para calcular quantos mol de Ca(OH)2 e de H2SO4 há em cada uma das amostras, fazemos a regra de três para cada um desses compostos:

Voltando à equação balanceada, temos:
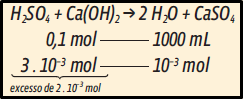
O excesso na concentração de H+ em H2SO4 é o responsável pelo pH da solução final. Para calcular a concentração, precisamos conhecer o volume que contém esse excesso:
Vtotal = volume da solução de Ca(OH)2 + volume da solução de H2SO4
Vtotal = 10 mL + 30 mL = 40 mL = 0,04 L.
Agora calculamos a concentração do ácido H2SO4 :
[H2SO4] = n mol /V
[H2SO4] = 2 . 10−3 mol/ 0,04L
[H2SO4] = 5 . 10−2 mol/L
Observando a ionização do ácido sulfúrico, temos
H2SO4 → 2 H+ + SO42−
1 mol 2 mol 1 mol
5 . 10−2 mol/L 10 . 10−2 mol/L
Sabendo que a [H+] = 10 . 10−2 mol/L = 10−1 mol/L e usando a escala de pH, concluímos que o pH desta solução é 1. Cor rosa.
CAPÍTULO 6
27. Basta analisar a estrutura do monômero. Primeiro, existe um anel aromático (que já era indicado, também, pelo termo benzeno em vinilbenzeno). Esse anel é a que contém mais átomos de carbono. Portanto, é a cadeia principal do monômero. E a essa cadeia principal está ligado um radical HC = CH2 . Identificando essas partes na estrutura do monômero:
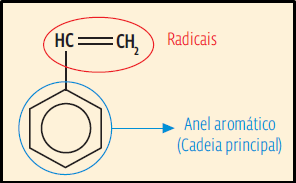
Repare que:
• O monômero tem uma anel aromático: cadeia aromática;
• a cadeia principal liga-se a um radical (HC = HC2): cadeia ramificada;
• na cadeia principal, o anel aromático tem ligações duplas entre carbonos: cadeia insaturada;
• não existe nenhum outro elemento além de carbono e hidrogênio: cadeia homogênea.
Temos, portanto, uma cadeia ramificada, insaturada, homogênea e aromática.
Resposta: B
28. Você deve se lembrar da característica dos isômeros ópticos: os compostos são química e fisicamente iguais, mas diferentes em suas propriedades fisiológicas (ou seja, agem diferentemente no organismo). No caso da forma S da talidomida, o fármaco provoca a malformação dos membros. A questão pede o motivo que causaria essa malformação congênita. Analisando as alternativas:
a) Incorreta. Na isomeria óptica os isômeros agem de forma diferente no organismo. O motivo de a forma S causar a malformação congênita não tem nada a ver com a reação química entre esses isômeros.
b) Incorreta. A malformação congênita também não é causada pela união entre os isômeros ópticos.
c) Incorreta. A malformação independe da concentração da talidomida na forma S.
d) Correta. Essa é a definição de isômeros ópticos. e) Incorreta. Os isômeros ópticos têm estruturas semelhantes, inclusive grupos funcionais. A diferença está na sua orientação espacial.
Resposta: D
29. A questão pede conhecimentos sobre polaridade e apolaridade de compostos e substâncias. Você deve lembrar que, para interagir, as moléculas devem ser ambas polares, ou ambas apolares. A água é polar e óleos e gorduras são apolares – suas moléculas não interagem entre si. Então, para dissolver óleos e gorduras, é necessário um composto que faça a ponte entre os dois, com uma extremidade polar e outra apolar. Cadeias longas de carbono (pelo menos 12 C) ligados a hidrogênios (hidrocarbonetos) são apolares. Mas isso muda se a cadeia longa contiver outro elemento químico, por exemplo, oxigênio ou nitrogênio. Nos sabões e detergentes, as cadeias carbônicas (apenas C ligados a H) são longas e contêm, numa das extremidades, uma função que lhes confere polaridade que atrai as moléculas de água. Mas, atenção, isso não significa que as cadeias carbônicas do sabão se dissolvam na água. Mais um detalhe: compostos que contenham outro elemento além de C e H mas em cadeias curtas (com menos de 12 C) não têm extremidade apolar – são sempre polares.
Analisando as alternativas, portanto:
a) Incorreta. A fórmula refere-se a um hidrocarboneto – apolar em ambas as extremidades.
b) Correta. A fórmula mostra que a cadeia tem uma parte apolar (17 C ligados a 33 H) e uma parte polar (COO−Na+).
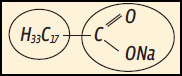
c) Incorreta. A extremidade COO−Na+ é polar. Mas a sua cadeia é pequena demais (apenas 2 C ligados a H) para ser apolar.
d) Incorreta. Novamente, esta molécula apresenta uma cadeia carbônica pequena (3 C). Portanto, não apresenta uma parte apolar.
e) Incorreta. Novamente, cadeia carbônica pequena demais para ter uma extremidade apolar.
Resposta: B
30. Você deve saber ler as fórmulas estruturais e identificar os grupos em cada cadeia. O grupo formado na reação é um éster (grupo RCOOR), surgido da reação entre o grupo carboxila (COOH) do ácido etanoico e a hidroxila (–OH) da vanila. Esta é uma reação de esterificação.
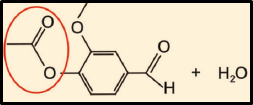
Resposta: A
31. Novamente, a questão pede que você identifique as funções orgânicas. Analisando cada alternativa:
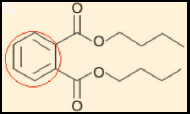
a) Incorreta. A função orgânica presente é éster (grupo RCOOR).
b) Incorreta. Cadeia alifática é sinônimo de cadeia aberta, mas o composto
apresenta cadeia aromática.
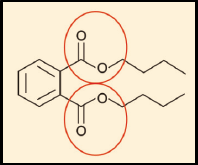
c) Correta. Aqui você deve saber ler a fórmula estrutural do dibutilftalato apresentada no enunciado, transformá-la em fórmula molecular e compará-la com a fórmula molecular fornecida na alternativa (C16H22O4). Lembre-se que, na fórmula estrutural bastão, as ligações entre C e H da cadeia carbônica são apresentadas em ziguezague. Lembrando que o carbono é tetravalente (ou seja, faz quatro ligações covalentes), você conta facilmente o número de carbonos e de hidrogênios do dibutilftalato. Veja:
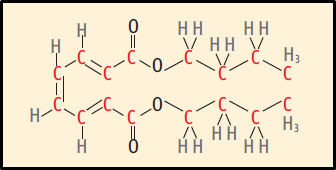
São 16 C; 22 H e 4 O.
d) Incorreta. Para ser solúvel em água, o composto deve ter uma extremidade polar e outra apolar. A função oxigenada numa das extremidades do dibutilftalato tornaria polar essa parte da molécula. No entanto, o tamanho da cadeia (16 C) é grande o suficiente para que a molécula seja considerada predominantemente apolar. E essa apolaridade a faz insolúvel em água.
e) Incorreta. O composto não apresenta isomeria geométrica, pois esse tipo de isomeria ocorre em compostos insaturados de cadeia aberta ou cadeia cíclica que apresente elementos (ligantes) diferentes unidos ao carbono da dupla.
Resposta: C
32. Para encontrar a fórmula molecular do composto basta contar o número de átomos de cada um dos elementos químicos. Veja:
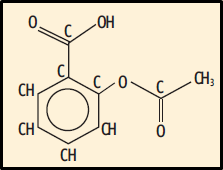
São 9 C, 8 H e 4 O. A fórmula correta é C9H8O4.
Os grupos funcionais orgânicos você encontra analisando a estrutura da fórmula estrutural. E lembrando: ésteres contêm uma carbonila[1] e 1 átomo de oxigênio entre carbonila e outro átomo de carbono. Ácidos carboxílicos contêm a função carboxila: COOH. Veja:
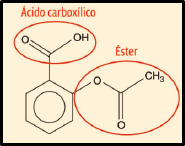
[1] = ![]()
Resolução: E









