Química: RAIO – X
Decifre os enunciados e veja as características típicas das questões que caem nas provas
FUVEST 2015 – 1ª Fase
A grafite de um lápis tem quinze centímetros de comprimento e dois milímetros de espessura. Dentre os valores abaixo, o que mais se aproxima do número e átomos[1] presentes nessa grafite é (Nota: Assuma que a grafite é um cilindro circular reto[2], feito de grafite pura. A espessura da grafite é o diâmetro da base do cilindro. Adote os valores aproximados de: 2,2 g/cm3 para a densidade[3] da grafite; 12 g/mol para a massa molar do carbono; 6,0 . 1023 mol – 1 [4] para a constante de Avogadro)
a) 5 x 1023
b) 1 x 1023
c) 5 x 1022
d) 1 x 1022
e) 5 x 1021
DICAS PARA A RESOLUÇÃO
Repare: as alternativas a, c e e trazem o mesmo valor 5, só que multiplicado por 10 elevado a expoentes diferentes: 21, 22 e 23. Não confie no chute. A alternativa correta é a c, cujo expoente é 22. Para chegar a essa resposta, é fundamental que você saiba fazer contas com potências de 10. Lembre-se: a cada vez que um valor é dividido por 10, o expoente cai em uma unidade.
[1] Seja prático e atento na leitura do enunciado. Depois de ler a questão por inteiro, releia o texto e grife os dados que realmente importam para a resposta. Neste caso: as medidas do grafite e o que você deve calcular: o número de átomos naquele grafite.
[2] Muitas das questões do Enem exigem mais do que o conhecimento específico na disciplina em questão. Nesta, para chegar à resposta correta, você deve associar conhecimentos de química à matemática. É preciso que você se lembre do cálculo de volume de um cilindro: Vcilindro = Abase . Altura.
[3] Aqui a questão exige que você domine um conceito da física: densidade é a massa de matéria em determinado volume: d = m/V
[4] Saber interpretar a notação matemática é também importante. A expressão mol– 1 usada para o número de Avogadro indica que o mol é o denominador de uma fração. A expressão poderia ser escrita assim: 6,0 . 1023 partículas (átomos) mol .
ENEM 2014
Diesel é uma mistura de hidrocarbonetos que também apresenta enxofre em sua composição. Esse enxofre é um componente indesejável, pois o trióxido de enxofre gerado é um dos grandes causadores da chuva ácida. Nos anos 1980[1], não havia regulamentação e era utilizado óleo diesel com 13 000 ppm de enxofre[2]. Em 2009, o diesel passou a ter 1 800 ppm de enxofre (S1800) e, em seguida, foi inserido no mercado o diesel S500 (500 ppm). Em 2012, foi difundido o diesel S50, com 50 ppm de enxofre em sua composição. Atualmente, é produzido um diesel com teores de enxofre ainda menores.
Os impactos da má qualidade do óleo diesel brasileiro. Disponível em: https://www.cnt.org.br. Acesso em: 20 dez. 2012 (adaptado).
A substituição do diesel usado nos anos 1980 por aquele difundido em 2012 permitiu uma redução percentual de emissão de SO3 de:
a) 86,2%.
b) 96,2%.
c) 97,2%.
d) 99,6%.
e) 99,9%.
DICAS PARA A RESOLUÇÃO
Repare: a questão não pede nenhum conhecimento de química, apenas de matemática. Para calcular o percentual de redução entre 1980 e 2012, você deve considerar o valor de 1980 como 100% e resolver o problema por uma simples regrinha de três. A alternativa correta é a d. Veja a resolução em detalhes no Simulado.
[1] Você consegue acompanhar o raciocínio do enunciado? O texto apresenta uma série de mudanças na concentração de enxofre no diesel usado no Brasil, em ordem cronológica, dos anos 1980 até hoje. E a questão refere-se a uma das etapas dessas mudanças. Leia atentamente o enunciado e vá anotando cada uma das etapas.
[2] Você deve estar familiarizado com a unidade ppm – partes por milhão, que indica concentração. No contexto da questão, 13 mil ppm de enxofre significa 13 mil átomos de enxofre a cada 1 milhão de moléculas do diesel. Esse conhecimento vem mais de leitura de jornais e revistas do que de aulas na escola. Quem se mantém atualizado em questões como aquecimento global já terá encontrado essa expressão em reportagens e relatórios que informam a concentração de gases do efeito estufa na atmosfera.
UNICAMP 2014
Explosão e incêndio se combinaram no terminal marítimo de São Francisco do Sul, em Santa Catarina, espalhando muita fumaça pela cidade e pela região. O incidente ocorreu com uma carga de fertilizante em que se estima tenham sido decompostas 10 mil toneladas de nitrato de amônio. A fumaça branca que foi eliminada durante quatro dias era de composição complexa, mas apresentava principalmente os produtos da decomposição térmica do nitrato de amônio: monóxido de dinitrogênio e água. Em abril de 2013, um acidente semelhante ocorreu em West, Estados Unidos da América, envolvendo a mesma substância. Infelizmente, naquele caso, houve uma explosão, ocasionando a morte de muitas pessoas.[1]
a) Com base nessas informações, escreva a equação química da decomposição térmica que ocorreu com o nitrato de amônio.
b) Dado que os valores das energias padrão de formação em kJ . mol-1 das substâncias envolvidas são nitrato de amônio (–366), monóxido de dinitrogênio (82) e água (–242), o processo de decomposição ocorrido no incidente é endotérmico ou exotérmico? Justifique sua resposta considerando a decomposição em condições padrão.
DICAS PARA A RESOLUÇÃO
A Os examinadores querem avaliar se você conhece a nomenclatura dos compostos (prefixos e sufixos). E se você tem capacidade de identificar no texto a estrutura básica da equação.
B Ao pedir que se justifique a resposta, você vai demonstrar não apenas o conhecimento que tem da disciplina, mas também a capacidade de associar conceitos. Nesta questão, você deve mostrar que a reação é exotérmica, libera calor. Veja o passo a passo no Simulado.
[1]Identifique o que realmente interessa para responder à questão. As menções ao acidente em Santa Catarina e a comparação com o evento nos Estados Unidos são dispensáveis.
UNIFOR 2014, adaptada
O dióxido de nitrogênio é um gás de cor castanho- avermelhada, de cheiro forte e irritante. É um agente oxidante forte e sua presença na atmosfera contribui para a formação de chuvas ácidas[1]. Em um recipiente contendo apenas NO2, ocorre o seguinte processo a temperatura constante: 2NO2(g) ↔ 2NO(g) + O2(g) As concentrações do reagente e dos produtos foram acompanhadas com o passar do tempo, conforme mostra o gráfico[2] abaixo.
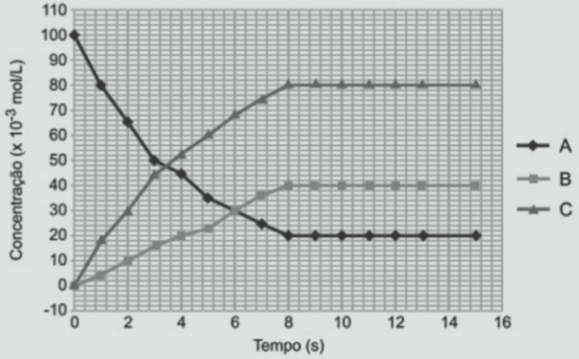
Analisando o gráfico, indique se a afirmação abaixo é verdadeira (V) ou falsa (F):
I. O aumento da pressão favorece a formação de NO(g) e O2(g).
II. Ao atingir o equilíbrio, a constante de equilíbrio terá valor de 640.
III. As curvas A, B e C representam respectivamente as concentrações de NO2, NO e O2.
IV. A partir de 6s o sistema atinge o equilíbrio e não ocorre alteração nas concentrações.
V. O aumento da pressão favorece o deslocamento da reação no sentido do NO2(g).
DICAS PARA A RESOLUÇÃO
Ⅲ Não se confunda. Para analisar se a alternativa é correta, você deve saber que a concentração dos reagentes sempre cai. Com isso, você já resolve que a linha A refere-se ao reagente NO2. Para definir a que produtos se referem as linhas B e C, é preciso obter da equação apresentada no enunciado a proporção entre o número de mol dos reagentes e dos produtos e comparar essa proporção com a concentração de cada substância, a partir do equilíbrio.
Ⅳ Para responder corretamente à questão, você deve se lembrar do conceito de equilíbrio químico: o ponto em que a concentração de reagentes e produtos se mantém constante. No gráfico, isso aparece no ponto em que todas as linhas se tornam paralelas – ou seja, o tempo passa, mas a concentração de cada substância não se altera.
Ⅴ Se você leu todas as afirmações antes de começar a resolver a questão, então reparou que a afirmação V é exatamente o inverso da alternativa I. Deslocar a reação – ou deslocar o equilíbrio de uma reação – é favorecer a reação direta ou a inversa. Então, se você já descobriu que a afirmação I é incorreta, esta só pode ser correta. Veja o passo a passo da resolução no Simulado.
[1] Problemas ambientais estão entre os temas mais comuns no Enem e vestibulares em geral, e não apenas em geografia. Em química, questões sobre aquecimento global, efeito estufa e chuva ácida aparecem regularmente. E, como ocorre muitas vezes, também, nem sempre a menção a algum desses problemas está relacionada ao que se pede na questão. Neste caso, por exemplo, a chuva ácida é citada apenas como parte da apresentação do composto. A resolução não depende de você conhecer o processo de aumento da acidez da chuva.
[2] Leitura de gráficos é habilidade cobrada praticamente em todas as provas do Enem, principalmente nas de física e química, além de matemática, é claro. Em química, você encontra gráficos em questões que tratam de temas como solubilidade e velocidade de reações.









