Matéria e energia: Termoquímica
Reações endotérmicas e exotérmicas, entalpia, entalpia-padrão e entalpia de formação
 Da matéria, a energia
Da matéria, a energia
Uma reação pode absorver ou liberar energia térmica, dependendo da entalpia dos reagentes e produtos
Toda transformação da matéria envolve uma transferência de energia – ou seja, toda reação química libera ou absorve energia do ambiente, geralmente na forma de calor. É o calor da queima do gás butano que cozinha os nossos alimentos. É também a energia térmica liberada na combustão do álcool ou da gasolina que movimenta os veículos. Mesmo para qualquer ser vivo, a energia das reações químicas é importante: o metabolismo dos alimentos – uma cadeia de reações químicas – fornece a energia para manter o funcionamento das células. A parte da química que estuda essas transferências de energia é a termoquímica.
Exotérmicas e endotérmicas
Existem dois tipos de reações químicas: as que fornecem calor ao ambiente e as que consomem calor do ambiente.
- • Reações exotérmicas liberam calor. É o que ocorre, por exemplo, nas reações de combustão de qualquer material. Veja a equação que representa a queima do etanol:
C2H6O(l) + 3 O2(g) → 2 CO2(g) + 3 H2O(g) + calor
- • Reações endotérmicas absorvem calor. É uma reação endotérmica a fotossíntese, realizada pelos vegetais: 6 CO2(g) + 6 H2O(l) + calor → C6H12O6(aq) + 6 O2(g)

Na equação de uma reação exotérmica, o calor é somado aos produtos, pois ele foi gerado pela reação e liberado para o ambiente. Já na equação de uma reação endotérmica, o calor é somado aos reagentes, pois é consumido como um deles, ao ser absorvido do ambiente.
Entalpia
Energia é a capacidade de produzir trabalho. A energia pode assumir diferentes formas, como química (das ligações entre os átomos e moléculas), térmica (calor) ou nuclear (das partículas do núcleo dos átomos). No Sistema Internacional de Unidades (SI), a unidade de medida da energia é o joule (J).
A energia não pode ser criada nem destruída, transformada de um tipo em outro. Toda substância guarda certa quantidade de energia química, que se transforma em calor quando reage. O total de energia armazenada nos reagentes e nos produtos de uma reação chama-se entalpia (H), medida em quilojoule (kJ). Numa reação química, a entalpia dos produtos e a dos reagentes varia. A variação de entalpia é dada por
ΔH = Hp – Hr , em que
- ΔH é a variação de entalpia;
- Hp é a entalpia dos produtos;
- Hr é a entalpia dos reagentes.
Transformação: A lei da conservação de energia diz que num sistema isolado a energia se mantém constante. Isso significa que toda energia que parece ter desaparecido terá apenas se transformado de química em outro tipo de energia, como elétrica, térmica, mecânica.
Uma reação pode ser exotérmica ou endotérmica. Numa reação exotérmica – aquela que libera calor –, a entalpia dos produtos (Hp) é menor que a dos reagentes (Hr). Se Hp < Hr, ΔH < 0. Inversamente, numa reação endotérmica, a entalpia dos produtos (Hp) é maior que a dos reagentes (Hr). Se Hp > Hr, ΔH > 0.
Entenda bem: a energia química fica armazenada nas ligações entre os átomos dos reagentes. Quando ocorre a reação, essas ligações se rompem e os átomos se reorganizam em novos compostos. Se a energia necessária para manter as novas ligações é menor do que aquela que mantinha as ligações dos reagentes, a diferença é liberada como calor.
Se, ao contrário, a energia necessária para manter as novas ligações é maior, então a reação absorve calor do ambiente. Esse calor absorvido será armazenado nos produtos sob a forma de energia química.

A combustão do etanol e uma reação exotérmica, libera energia térmica. Veja:
C2H6O(l) + 3 O2(g) → 2 CO2(g) + 3 H2O(g) + calor
Hr > Hp → ΔH < 0
A fotossíntese e uma reação endotérmica:
6 CO2(g) + 6 H2O(l) + calor → C6H12O6(aq) + 6 O2(g)
Hr < Hp → ΔH > 0
Como varia a entalpia
Em laboratório é possível medir a energia absorvida ou liberada numa reação. A quantidade
de calor envolvida numa reação é descrita numa equação termoquímica.
A equação da reação que transforma os gases hidrogênio e cloro em ácido clorídrico é:
H2(g) + Cl2(g) → 2 HCl(g)
ΔH ≅ –185 kJ (25°C, 1 atm)
A equação fornece os seguintes dados:
O estado físico das substâncias – gasoso (g);
- • Temperatura (25°C ) e pressão (1 atm) sob as quais a reação ocorre;
- • A proporção entre reagentes e produtos: um mol de H2 reage com 1 mol de Cl2 para formar
2 mol de HCl;
- • A variação de energia para essa reação específica, que produz 2 mol de HCl, é ≅ –185 kJ. Para 1 mol de HCl, ΔH ≅ –92,5 kJ.
- • Se a variação de entalpia dessa reação é negativa (ΔH < 0), então a energia foi liberada como calor. Portanto, a reação é exotérmica.
Repare que:
- • A quantidade de energia liberada ou absorvida é proporcional à estequiometria da reação. Na produção de 2 mol de HCl, o calor liberado vale, aproximadamente, 185 kJ, então, para a produção de 4 mol de HCl, essa quantidade é duas vezes maior (≅ 370 kJ).
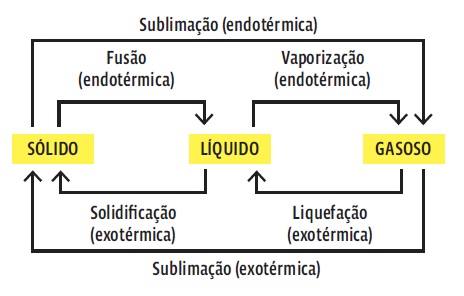
- • A quantidade de energia armazenada numa substância depende de seu estado físico. O estado gasoso é o de maior entalpia, e o sólido, o de menor. HCl em estado gasoso armazena mais energia do que no estado líquido porque as partículas têm maior energia cinética.
- • A pressão e a temperatura em que uma reação ocorre também importam. Um gás comprimido ou aquecido tem mais energia do que um sob temperatura e pressão normais. Sempre que ocorre uma mudança do estado físico, a energia armazenada no sistema se altera e, consequentemente, a entalpia das substâncias. Veja:
- • sólido → líquido → gasoso
- • Hs < Hl < Hg
- • Então essas transições são endotérmicas. Então, no sentido inverso, quando a temperatura
cai:
- • gasoso → líquido → sólido
- • Hg > Hl > Hs
- • Essas transições são exotérmicas.
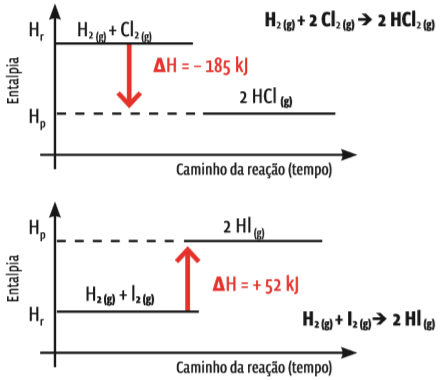
A variação da entalpia é representada em diagramas de entalpia. Veja o diagrama para uma reação exotérmica e outra, endotérmica:
Entalpia vai, Entalpia vem A primeira reação é exotérmica, e a segunda, endotérmica. Nos diagramas, a medida de entalpia está indicada no eixo vertical. O ponto Hr é a medida de entalpia dos reagentes. Repare que essa entalpia permanece constante enquanto a reação não tem início. Quando a reação se completa, a entalpia dos produtos (Hp) está num ponto diferente, no eixo vertical – acima ou abaixo do ponto Hr. Isso significa que a entalpia variou. A diferença de altura entre as duas retas indica a medida da variação de entalpia (∆H) de cada uma das reações, e o sentido dessa variação mostra se a reação é exotérmica ou endotérmica.
Combustão
Toda combustão é uma reação na qual um combustível reage com o comburente oxigênio (O2) liberando energia – ou seja, toda combustão é uma reação exotérmica. A combustão completa de uma substância orgânica (que contém carbono) ocorre quando, na reação com o oxigênio do ar, formam-se gás carbônico (CO2) e água (H2O). A respiração é uma combustão completa: o oxigênio inalado “queima” os alimentos, liberando energia. Quando falta oxigênio, ocorre a combustão incompleta, cujos produtos são monóxido de carbono (CO) e fuligem. A combustão incompleta libera menos calor que a completa – ou seja, para uma mesma quantidade de combustível, a combustão incompleta produz menos energia. Veja:
- • Combustão completa:
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(g)
ΔH = – 802 kJ/mol
- • Combustão incompleta:
CH4(g) + 3/2 O2(g) → CO(g) + 2 H2O(g)
ΔH = – 520 kJ/mol
Sabendo-se a quantidade de calor liberada por diferentes combustíveis, pode-se comparar o valor energético de cada um deles – ou seja, quanta energia cada um rende no motor de um veículo, por exemplo.
Entalpia-padrão
Em laboratório, consegue-se medir apenas a variação de energia de uma reação. Para fazer previsões quanto ao calor liberado ou absorvido de uma reação – e, daí, definir a energia química de cada substância –, os químicos criaram um padrão e, a partir dele, uma escala relativa – a entalpia-padrão (H0).
Numa reação de combustão, falamos em entalpia- padrão de combustão. Nas reações que formam uma substância composta a partir de substâncias simples, falamos em entalpia-padrão de formação. A entalpia-padrão é sempre dada para a substância em seu estado físico mais comum nas condições-padrão. Por convenção, as substâncias simples (compostas de um único elemento químico, como C(s), O2(g), H2(g) e Fe(s)) têm entalpia zero.
CONDIÇÕES-PADRÃO: As condições-padrão são: temperatura de 25°C e pressão de 1 atmosfera (atm). E nessas condições que são definidas a entalpia de qualquer substancia e a entalpia-padrão de qualquer reação. O expoente zero sobre o H, em H° ou ΔH°, significa que a entalpia e sua variação foram calculadas nessas condições.
Entalpia de formação
Os gases hidrogênio (H2) e oxigênio (O2) são substâncias simples e, por isso, têm entalpia-padrão zero. Mas, ao reagir, os dois gases produzem água. Essa é uma reação exotérmica:
H2(g) + ½ O2 (g) → H2O(l) ΔH° = – 286 kJ
Como a água é o único produto formado pela reação, podemos dizer que toda a entalpia está nas moléculas de água. Esse valor é chamado entalpia-padrão de formação (ΔH°f ). O valor da entalpia-padrão de formação é sempre calculado para um mol da substância produzida.
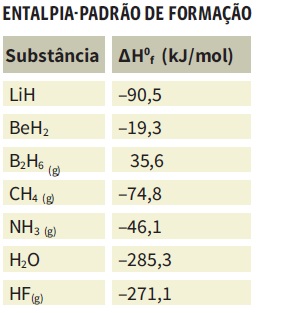
Todas as substâncias têm a entalpia de formação medida em laboratório. Veja a entalpia-padrão de formação de algumas delas:

Lei de Hess
Em 1840, o russo Germain Henri Hess verificou que a quantidade de energia térmica liberada numa reação não depende de seu caminho, apenas dos estados inicial e final da reação. A lei de Hess afirma que a variação de energia térmica num processo químico depende somente das propriedades das substâncias nos estados inicial e final. Essa variação é a mesma, não importando se o processo se realiza em um ou em diversos estágios.

LEI DE HESS
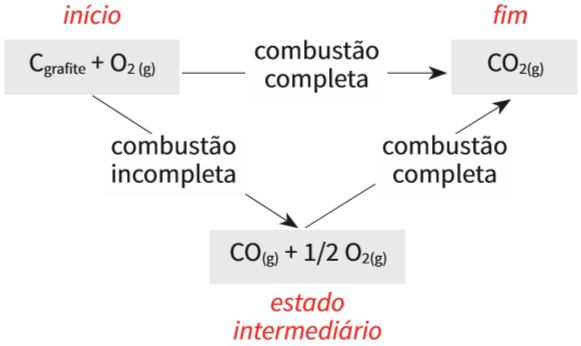
O dióxido de carbono (CO2) pode ser gerado da combustão do carbono grafite, por duas reações distintas. Veja:
GRAFITE: O grafite é um alótropo do carbono – ou seja, uma dentre várias substâncias compostas apenas de átomos de carbono. Outro alótropo do carbono é o diamante. A diferença entre eles é a conformação geométrica em que os átomos se organizam.
- • Caminho 1: o CO2 pode se formar por combustão completa do grafite:
C (s) + O2 (g) → CO2 (g) ΔH = –393 kJ/mol
- • Caminho 2: o CO2 pode se formar, também, por duas etapas de combustão:
Etapa I : C (s) + ½ O2 (g) → CO (g)
ΔH1 = –110 kJ/mol (combustão incompleta)
Etapa II: CO (g) + ½ O2 (g) → CO (g)
ΔH2 = –283 kJ/mol (combustão completa)
Organizando e somando as equações do caminho 2:
Etapa I: C (grafite) + 1/2 O2(g) → CO(g) ΔH1 = –110 kJ/mol
Etapa II: CO(g) + 1/2 O2(g) → CO2(g) ΔH2 = –283 kJ/mol
A soma das equações, passo a passo:
- • Eliminamos substancias que foram formadas na etapa1 e consumidas na etapa 2 – o CO;
- • Somamos o numero de moléculas das substancias restantes:
½ O2 + ½ O2 = 1 O2;
- • Somamos, também, as variações de entalpia das duas etapas:
ΔH = –110 – 283 = –393 kJ/mol
- • A equação que resulta da soma e o que se chama reação
global – uma equação que representa a reação direta,
sem as etapas intermediarias:
Etapa I: C (grafite) + 1/2 O2(g) → CO(g) ΔH1 = –110 kJ/mol
Etapa II: CO(g) + 1/2 O2(g) → CO2(g) ΔH2 = –283 kJ/mol
Reação global: C(grafite) + O2(g) → CO2(g) ΔH = –393 kJ/mol
Compare o resultado dessa soma com a reação de combustão completa do carbono (caminho 1). E confirme
a lei de Hess:
- • A reação global e a reação do caminho 1;
- • A soma das variações de entalpia das duas etapas do caminho 2 (ΔH1 e ΔH2) e igual a variação de entalpia
da reação global.
A lei de Hess num diagrama de entalpia dessa reação:
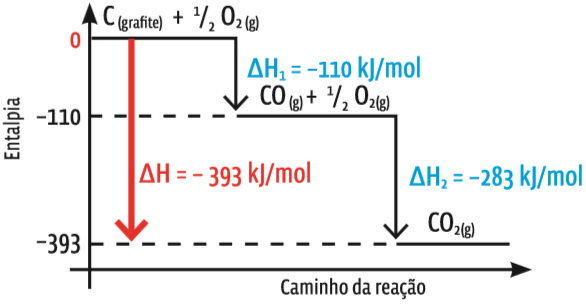
Direto ou com escalas O diagrama mostra a variação de entalpia de duas reações que, em sequência, produzem CO2. A reação 2 ocorre entre o CO produzido na primeira reação com O2, resultando em CO2, numa combustão completa. A soma das duas variações de entalpia é a variação de entalpia da reação global: ∆H = ∆H1 + ∆H2 = –393 kJ/mol.

É comum que as equações químicas tragam coeficientes em frações. E o que acontece na equação da formação da água aqui apresentada, em que 1 H2 reage com . O2. Meio O2 não significa meia molécula, mas meio mol de moléculas de oxigênio (3 . 1023 moléculas). As frações são necessárias quando se calcula a entalpia-padrão (sempre para um mol) de uma substancia formada.
A matemática das reações
Ao calcular a variação de entalpia pela lei de Hess, comparamos duas ou mais reações químicas. Nesse caso, é comum que precisemos somar as equações. Essa soma segue as regras para a soma de equações matemáticas. E, assim como na matemática, em química pode-se usar uma série de truques para resolver a conta: multiplicar, dividir ou inverter as equações para obter os coeficientes estequiométricos necessários. Entenda, a seguir, a lógica dessa soma.


Na soma de equações químicas, podemos multiplicar, dividir ou inverter as equações para obter os coeficientes estequiométricos necessários. Mas não se esqueça de que:
• Ao inverter uma equação, o sinal algébrico de sua ΔH também é invertido;
• Se a equação tiver os coeficientes multiplicados ou divididos, ΔH deve ser multiplicado ou dividido pelo mesmo valor;
• Na soma, quando substâncias iguais em reações diferentes estão de lados opostos, podemos cancelá-las (ou simplificá-las, caso seus coeficientes sejam diferentes).