Eletroquímica
Compartilhe essa matéria: Link copiado! Reações químicas podem produzir correntes elétricas e correntes elétricas podem produzir reações químicas de óxido-redução. Temos então: A. Pilhas, baterias e acumuladores – são dispositivos que produzem corrente elétrica por intermédio de uma reação espontânea de óxido-redução. B. Eletrólise – é o processo de obtenção de uma reação de óxido-redução […]
Reações químicas podem produzir correntes elétricas e correntes elétricas podem produzir reações químicas de óxido-redução. Temos então:
A. Pilhas, baterias e acumuladores – são dispositivos que produzem corrente elétrica por intermédio de uma reação espontânea de óxido-redução.
B. Eletrólise – é o processo de obtenção de uma reação de óxido-redução por meio de uma corrente elétrica.
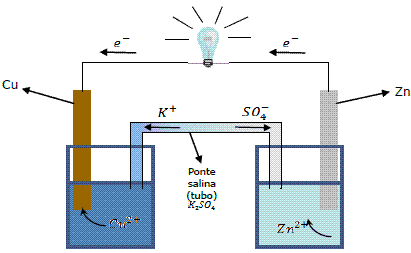
A. Pilhas – existem vários tipos de pilhas e baterias, mas por motivos didáticos adota-se, normalmente, o esquema exemplo abaixo, chamada de pilha de Daniell:

No eletrodo de cobre (Cu) (catodo):

No catodo ocorre a redução.
No eletrodo de zinco (Zn) (anodo):

No anodo ocorre a oxidação.
Por convenção internacional a reação de uma pilha é:

1. Potenciais de oxidação e de redução
2. Determinação do potencial de redução
Para a determinação do potencial de redução utiliza-se um eletrodo de gás hidrogênio, considerado como de potencial de redução zero.
3. Maior potencial de redução
Em uma pilha, o elemento que possui maior potencial de redução é que sofre a redução, enquanto aquele que tem maior potencial de oxidação sofre a oxidação.
A tabela abaixo mostra os potenciais de redução de alguns elementos (em solução aquosa a 25°C):

Determinação da fem (E) (força eletromotriz) de uma pilha – a fem de uma pilha pode ser determinado pela diferença entre os potenciais de redução dos eletrodos da pilha:

Por exemplo, em uma pilha de alumínio e cobre:

Eletrólise – é uma reação química, onde existam íons, produzida por uma corrente elétrica. A eletrólise pode ser ígnea ou em meio aquoso.
Eletrólise ígnea – é feite na ausência de água, com a substância pura no estado líquido (fundida). Por exemplo, a eletrólise do cloreto de sódio (NaCl) que produz sódio metálico (Na) e cloro (Cl2) na forma de gás, utilizando eletrodos de platina:

Sendo as reações intermediárias:

Com duas semi-reações:

Somando-se (I) e (II):

Eletrólise em meio aquoso – nesse tipo de reação não se levam em conta somente os íons dos solutos, mas também os da água que se ioniza. Utilizando-se o exemplo do cloreto de sódio (NaCl) acima, agora em meio aquoso, temos duas eletrólises:

e:

Somando-se as quatro semi-reações:

Quantificação de carga na eletrólise – para o cálculo da corrente elétrica necessária para a eletrólise temos, por exemplo, para a prata:Quantificação de carga na eletrólise – para o cálculo da corrente elétrica necessária para a eletrólise temos, por exemplo, para a prata:

Como cada elétron possui uma carga elementar de:

A carga total será:

Exercícios:
1. (PUC) Na pilha eletroquímica sempre ocorre:
a) oxidação do catodo.
b) movimento de elétrons no interior da solução eletrolítica.
c) reação com diminuição de calor.
d) passagem de elétrons, no circuito externo, do anodo para o catodo.
e) reação de neutralização.
2.

3.
a) A concentração dos íons nitrato diminui no processo.
b) O cobre metálico é oxidado pelos íons prata.
c) O íon prata cede elétrons à placa de cobre.
d) O íon prata é o agente redutor.
e) Um íon prata é reduzido para cada átomo de cobre arrancado da placa.
4.
a) 0,44 V.
b) 1,12 V.
c) – 0,44 V.
d) – 1,12 V.
e) 2,29 V.
Respostas:
1. d.
2. e.
3. b.
4. c.

 SEGUIR
SEGUIR
 SEGUINDO
SEGUINDO