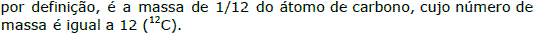Está consolidado o conceito de que a Química estuda, principalmente, as reações que ocorrem ao se misturar duas ou mais substâncias (reagentes) para produzir outras substâncias, chamados de produtos. Mas quanto de cada reagente deve ser usado para se obter a quantidade de produto desejado? Este é justamente o objeto de estudo da estequiometria.
1. Determinação de fórmulas pela relação de massa
Unidade de massa atômica (u) 
Os valores das massas atômicas utilizados são comumente arredondados.
Por exemplo:

Obs.: A massa atômica de um elemento é a média ponderada da massa de seus isótopos. Essa média ponderada leva em conta a quantidade de cada isótopo encontrado na natureza.
Constante de Avogadro
É uma constante da natureza que corresponde numericamente ao número de átomos da massa atômica de uma substância.
N = 6,022 . 10²³
Mol: é a massa molecular de uma substância.
Por exemplo:
Massa atômica do hidrogênio: 1 u
Massa atômica do oxigênio: 16 u

2. Cálculos estequiométricos
– Lei de Lavoisier: indica que numa reação química em um sistema fechado, a soma das massas dos reagentes é igual à soma das massas dos produtos. (“Na natureza nada se cria, nada se perde, tudo se transforma”).
– Lei de Proust: indica que uma mesma substância apresenta sempre a mesma proporção dos elementos que a compõem.
– Lei de Gay-Lussac: indica que, nas mesmas condições de temperatura e pressão, os volumes dos gases participantes de uma reação química mantêm entre si uma relação de números inteiros e pequenos.
Obs.: Em CNTP (condições normais de temperatura e pressão – 273K e 1 atm) um mol de gás ocupa 22,4 L.
As reações químicas devem obedecer a essas leis. Por exemplo, para a obtenção de água deve-se reagir hidrogênio e oxigênio: Esta é uma equação desbalanceada, pois, a quantidade de átomos de oxigênio do lado esquerdo (reagente 2) é diferente da quantidade de átomos de oxigênio do lado direito (produto 1)
Balanceando a equação:
 A quantidade de átomos dos reagentes é igual à quantidade de átomos dos produtos.
A quantidade de átomos dos reagentes é igual à quantidade de átomos dos produtos.
Outro exemplo de equação já balanceada:

Essa proporcionalidade também se estende para as massas moleculares (mols) e para as massas dos reagentes:
2 . 30 + 7 . 32 = 4 . 44 + 6 . 18
60 + 224 = 176 + 108 (I)
284 = 284 → equação equilibrada

Havendo excesso de reagente, haverá sobra deste. Por exemplo, se na reação (I) fossem colocados 100g de etano para reagir com 224g de oxigênio restariam 40g de etano após o término da reação.
Neste caso os 224g de oxigênio seriam a massa de reagente limitante.
Exercícios:
1.
2.

3.
(Vunesp-SP) Na Natureza, de cada cinco átomos de boro, um tem massa atômica iguala 10 u e quatro têm massa atômica iguala 11 u. Com base nesses dados a massa atômica do boro, expressa em u, é igual a:
a. 10.
b. 10,5.
c. 10,8.
d. 11.
e. 11,5.
4.

Respostas:
1. 
2. a.
3. c.
4. c





 Qual é o plural de lápis?
Qual é o plural de lápis? Gabarito oficial do Enem 2024: confira todos aqui
Gabarito oficial do Enem 2024: confira todos aqui Questão de Física do Enem 2024 é anulada; veja qual
Questão de Física do Enem 2024 é anulada; veja qual 5 dicas de última hora para quem não leu os livros obrigatórios da Fuvest
5 dicas de última hora para quem não leu os livros obrigatórios da Fuvest Confira nota de corte da Unicamp 2025 primeira fase
Confira nota de corte da Unicamp 2025 primeira fase