Cada elemento químico é definido por meio de seu número atômico.
1. O número atômico (Z) indica a quantidade de prótons (p) do átomo do elemento.
Por exemplo: Magnésio (Mg) Z=12 (Z=p)
2. O número de massa atômica (A) é a soma das massas unitárias dos prótons (p) com a dos nêutrons (n).
Por exemplo: Magnésio (Mg) A=24 (A=p+n)
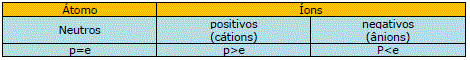
Obs.: como os átomos são eletricamente neutros, o número de prótons é igual ao número de elétrons. Já nos íons a uma preponderância de um deles: se o número de prótons é maior que o de elétrons, o íon é positivo; caso contrário, é negativo.

p=número de prótons e=número de elétrons n=número de nêutrons
Existem características que reúnem átomos de um ou mais elementos, formando grupos. São eles:

Os prótons e nêutrons compõem o núcleo do átomo. Os elétrons, por sua vez, distribuem-se na eletrosfera em níveis e subníveis de energia. São 7 níveis, e cada um deles pode ter de 1 a 4 subníveis.
O diagrama de Linus Pauling indica a ordem de preenchimento dos subníveis por elétrons:


Obs.: As massas atômicas na tabela periódica são calculadas por uma média ponderada das massas dos isótopos de cada elemento encontrados na natureza.
Algumas famílias (colunas) de elementos possuem designação própria, por exemplo:
1 – metais alcalinos
2 – metais alcalinos terrosos
17 – halogênios
18 – gases nobres
Algumas propriedades da tabela periódica:

Exercícios:
(PUC-SP) O elemento de maior eletronegatividade é o que apresenta a seguinte configuração eletrônica:
(Fuvest) Os elementos químicos se relacionam de diferentes maneiras com os organismos vivos. Alguns elementos são parte da estrutura das moléculas que constituem os organismos vivos. Outros formam íons essenciais à manutenção da vida. Outros, ainda, podem representar riscos para os seres vivos: alguns, por serem tóxicos; outros, por serem radioativos. Observe o esquema da Tabela Periódica, no qual estão destacados quatro elementos químicos, identificados pelas letras w, x, y e z:

Considerando suas posições na Tabela Periódica, assinale a alternativa que melhor associa esses quatro elementos químicos com as propriedades discutidas acima.

(Cesgranrio) Considerando um Grupo ou Família na Tabela Periódica, podemos afirmar em relação ao raio atômico:
a. Aumenta com o aumento do número atômico, devido ao aumento do número de camadas.
b. Aumenta à medida que aumenta a eletronegatividade.
c. Não sofre influência da variação do número atômico.
d. Diminui à medida que aumenta o número atômico, devido ao aumento da força de atração do núcleo.
e. Diminui com o aumento do número atômico, devido ao aumento do número de elétrons.





 Qual é o plural de lápis?
Qual é o plural de lápis? Gabarito oficial do Enem 2024: confira todos aqui
Gabarito oficial do Enem 2024: confira todos aqui Questão de Física do Enem 2024 é anulada; veja qual
Questão de Física do Enem 2024 é anulada; veja qual Confira nota de corte da Unicamp 2025 primeira fase
Confira nota de corte da Unicamp 2025 primeira fase 5 dicas de última hora para quem não leu os livros obrigatórios da Fuvest
5 dicas de última hora para quem não leu os livros obrigatórios da Fuvest