Resumo de Química: Reações endotérmicas e exotérmicas
Todas as reações químicas e bioquímicas liberam ou absorvem energia do ambiente de alguma forma. Os processos que liberam calor são denominados exotérmicos e nos transmitem sensação de aquecimento. É o caso, por exemplo, das combustões. Por outro lado, a sensação de frio que sentimos ao sair de um banho, ou quando pegamos um cubo […]
Todas as reações químicas e bioquímicas liberam ou absorvem energia do ambiente de alguma forma. Os processos que liberam calor são denominados exotérmicos e nos transmitem sensação de aquecimento. É o caso, por exemplo, das combustões.
Por outro lado, a sensação de frio que sentimos ao sair de um banho, ou quando pegamos um cubo de gelo, está associada a processos endotérmicos. Tais processos – evaporação e fusão da água – absorvem calor do ambiente e isso pode ser percebido pelo nosso corpo.
Reações exotérmicas
Ao contrário das reações endotérmicas, as reações exotérmicas possuem um balanço negativo de energia quando se compara a entalpia total dos reagentes com a dos produtos. Assim, a variação entálpica final é negativa (produtos menos energéticos do que os reagentes) e indica que houve mais liberação de energia, na forma de calor, para o meio externo que absorção – também sob forma de calor.
A temperatura final dos produtos é maior que a temperatura inicial dos reagentes.
O esquema de uma reação exotérmica pode ser representado da seguinte forma: 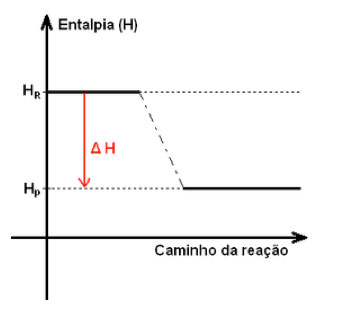
Reações endotérmicas
Já numa reação endotérmica, o fornecimento de energia desloca o equilíbrio para a formação de produtos. Uma vez que este processo absorve calor do meio.
As reações endotérmicas têm como característica possuírem balanço energético positivo quando é comparado a energia entálpica dos produtos em relação aos reagentes. Assim, a variação dessa energia (variação de entalpia) possui sinal positivo (+ΔH) e indica que houve mais absorção de energia do meio externo que liberação. Ambas em forma de calor.
Como consequência, a temperatura dos produtos finais é menor que a dos reagentes.
O esquema de uma reação exotérmica pode ser representado da seguinte forma: 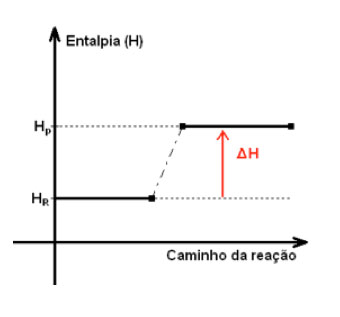

 SEGUIR
SEGUIR
 SEGUINDO
SEGUINDO

 Qual o masculino de barata?
Qual o masculino de barata? É ‘Yakissoba’ ou ‘Yakisoba’? O jeito certo vai te surpreender
É ‘Yakissoba’ ou ‘Yakisoba’? O jeito certo vai te surpreender ‘Bandeja’ ou ‘bandeija’: qual é o certo?
‘Bandeja’ ou ‘bandeija’: qual é o certo? Qual é o feminino de cavalheiro?
Qual é o feminino de cavalheiro? “Canção para ninar menino grande”: resumo e análise da obra de Conceição Evaristo
“Canção para ninar menino grande”: resumo e análise da obra de Conceição Evaristo








