Soluções – Química
Na natureza dificilmente as substâncias se apresentam na sua forma pura. Quase sempre elas se apresentam na forma de misturas. Misturas homogêneas são aquelas em que é impossível distinguir individualmente cada um de seus componentes. Sua aparência é portanto uniforme e homogênea. Às misturas homogêneas dá-se o nome de soluções. As soluções podem ser: – […]
Na natureza dificilmente as substâncias se apresentam na sua forma pura. Quase sempre elas se apresentam na forma de misturas.
Misturas homogêneas são aquelas em que é impossível distinguir individualmente cada um de seus componentes. Sua aparência é portanto uniforme e homogênea.
Às misturas homogêneas dá-se o nome de soluções.
As soluções podem ser:
– Gasosas, como por exemplo, o ar, que é uma mistura de gases.
– Líquidas, como a água do mar, que apresenta uma série de materiais sólidos (sais como cloreto de sódio, sulfato de magnésio, etc.).
– Sólidas, como as ligas metálicas (latão, que é uma liga de cobre e zinco).
Existem também soluções de gases em líquidos; um exemplo comum é o gás carbônico dissolvido no refrigerante.
1. Quantificação das soluções
Os componentes de uma solução são o solvente e o soluto. Normalmente dissolve-se o soluto no solvente. A quantidade de soluto a ser dissolvido depende da temperatura em que ocorre a solução, da natureza do soluto e do solvente, e da concentração, que é a grandeza que relaciona a massa de soluto com o volume total da solução.

Obs.: Os índices aqui usados serão 1 para o soluto, 2 para o solvente e ausência de índice para a solução como um todo.
Densidade de uma solução é a relação entre a massa e o volume da solução:

Título em massa de uma solução é relação entre as massas de soluto e da solução:

Título em porcentagem de uma solução é relação entre as massas de soluto e da solução dada em porcentagem:

Título em volume de uma solução é relação entre o volume de soluto e da solução, pode ser dada em porcentagem:

Molaridade, ou concentração em mol por volume, ou concentração molar de uma solução é relação entre o número de mols de soluto e o volume da solução:

Molalidade, ou concentração em molal de uma solução é relação entre o número de mols de soluto e a massa solvente:

Relações entre a concentração, o título, a densidade e a molaridade:
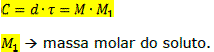
Fração molar é a relação entre o número de mols do soluto (ou do solvente) pelo número de mols da solução:

Relações entre a concentração, o título, a densidade e a molaridade:
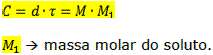
2. Diluição de soluções (mesmo soluto)
Ao se adicionar mais solvente a uma solução há uma diluição da solução inicial, com:

3. Mistura de soluções (mesmo soluto e mesmo solvente)
Ao se misturar soluções de mesmo soluto e mesmo solvente:

Obs.: para a mistura de soluções de mesmo solvente e solutos diferentes é uma diluição dos solutos em um volume maior de solvente proveniente da soma das duas soluções.
Exercícios:
1.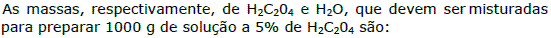
a. 60 g e 940 g.
b. 90 g e 910 g.
c. 50 g e 950 g.
d. 108 g e 892 g.
e. 70 g e 930 g.
2.
a. R$ 0,71.
b. R$ 0.355.
c. R$ 1,42.
d. R$ 2,84.
e. R$ 1,00.
3. (Unicamp-SP) Um dos grandes problemas das navegações do século XVI referia-se à limi¬tação de água potável que era possível trans¬portar numa embarcação. Imagine uma situa¬ção de emergência em que restaram apenas 300 litros (L) de água potável (considere-a completamente isenta de eletrólitos). A água do mar não é apropriada para o consumo devi¬do à grande concentração de NaCl (25 g/L), porém o soro fisiológico (10 g NaCl/L) é. Se os navegantes tivessem conhecimento da composição do soro fisiológico, poderiam usar a água potável para diluir água do mar de modo a obter soro e assim teriam um volume maior de líquido para beber.
a. Que volume total de soro seria obtido com a diluição se todos os 300 litros de água potável fossem usados para este fim?
b. Considerando-se a presença de 50 pes¬soas na embarcação e admitindo-se uma distribuição equitativa do soro, quantos gramas de NaCl teriam sido ingeridos por cada pessoa?
c. Uma maneira que os navegadores usavam para obter água potável adicional era reco¬lher água de chuva. Considerando-se que a água da chuva é originária, em grande parte, da água do mar, como se explica que ela possa ser usada como água potável?
4. (Fuvest-SP) Se adicionarmos 80 mL de água a 20 mL de uma solução 0,1 molar de hidró¬xido de potássio, obteremos uma solução de concentração molar igual a:
a. 0,010.
b. 0,020.
c. 0,025.
d. 0,040.
e. 0,050.
Respostas:
1. c.
2. a.
3.
a. 500L
b. 100g/pessoa
c. os sais contidos na água do mar não evaporam junto com ela, ao contrário se for desprezados as partículas (poluentes) presentes no ar da atmosfera a água da chuva é considerada destilada (pura).
4. b.


 Governo oferece cursos gratuitos de Ciência de Dados; veja como participar
Governo oferece cursos gratuitos de Ciência de Dados; veja como participar A 100 dias do Enem 2024, veja os assuntos que mais caem na prova
A 100 dias do Enem 2024, veja os assuntos que mais caem na prova A primeira mulher negra a participar da delegação olímpica brasileira
A primeira mulher negra a participar da delegação olímpica brasileira Sena: como funciona a despoluição de um rio
Sena: como funciona a despoluição de um rio “Etiologia” ou “etimologia”: qual é o certo?
“Etiologia” ou “etimologia”: qual é o certo?








