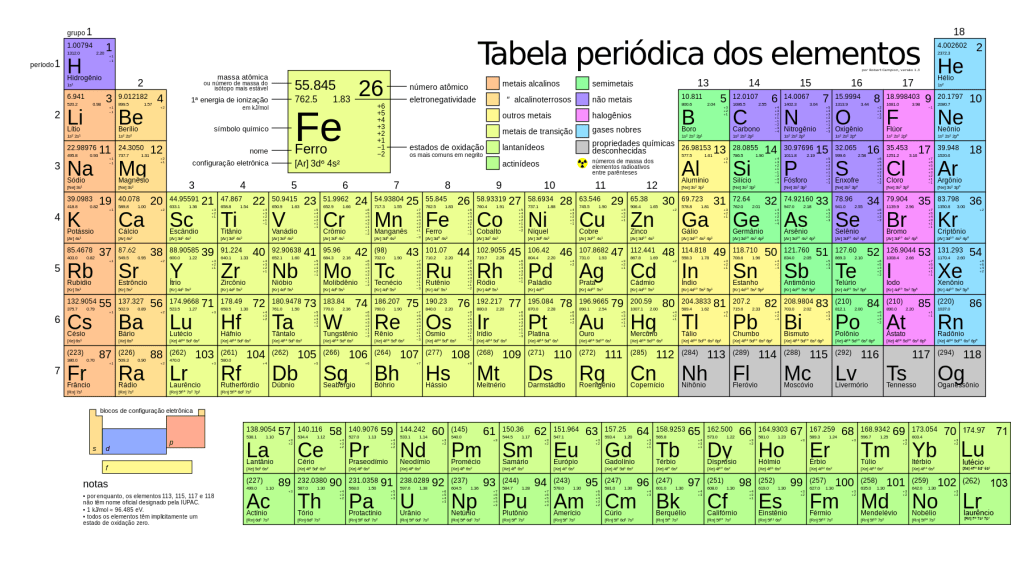
Abrir um livro de Química pela primeira vez e se deparar com uma tabela cheia de letras e números pode ser uma experiência assustadora. Mas acredite, não há nada o que temer! Muito pelo contrário: a tabela periódica é extremamente lógica e uma ferramenta das mais valiosas para compreender e prever como os elementos químicos se comportam.
Não conhecê-la, por outro lado, pode complicar sua vida: basicamente todos os conteúdos da Química pressupõem um conhecimento básico da tabela. Isso não quer dizer, é claro, que o estudante precisa decorar e saber recitá-la do início ao fim. Mais importante que isso é saber interpretar as informações trazidas por ela – e neste texto, te ensinamos a fazer exatamente isso!
A história da tabela periódica
A tabela periódica tal qual a conhecemos hoje foi proposta em 1869, pelo químico russo Dmitri Mandeleev, como uma forma de agrupar todos os elementos químicos conhecidos, de acordo com algumas propriedades que se repetiam em intervalos regulares.
Antes dele, outros pesquisadores tentaram fazer essa organização, mas Mendeleev foi mais sagaz: ele percebeu que faltavam informações para completar a tabela, porque nem todos os elementos haviam sido descobertos ainda – e assim, deixou lacunas que foram sendo preenchidas e revisadas ao longo dos anos.
Na sua versão mais moderna, atualizada pela IUPAC (International Union of Pured and Applied Chemestry) em 2022, a tabela periódica apresenta 118 elementos. Destes, 92 existem naturalmente no mundo e os outros 26 são artificiais.
+ Todas as principais fórmulas de Química
Elementos, períodos e grupos
A tabela periódica está organizada em ordem crescente de número atômico, do Hidrogênio (número 1) ao Oganessônio (número 118). Este valor, que representa a quantidade de prótons existentes no núcleo de um átomo de cada elemento, aumenta dentro da tabela da esquerda para a direita e de cima para baixo, isto é, seguindo a mesma ordem de um texto normal.
Olhando individualmente para cada quadradrinho, já conseguimos descobrir o nome e sigla do elemento, seu número atômico e sua massa atômica. Por exemplo: o sódio tem a sigla Na (de Natrium, seu nome em Latim), 11 prótons em seu núcleo e massa atômica de 22,99u (unidade de medida que se refere a 1/12 da massa do Carbono-12).

Além disso, existem na tabela 7 linhas, chamadas de Períodos, e 18 colunas, chamadas de Grupos. É como um jogo de xadrez: cada elemento tem uma localização específica, e só de bater o olho e notar em qual parte da tabela eles estão, podemos entender algumas de suas características e propriedades.
Elementos em um mesmo período apresentam a mesma quantidade de camadas de elétrons. O Cálcio e o Potássio, por exemplo, estão na linha 4, portanto, seus elétrons se distribuem até a quarta camada de cada um de seus átomos. Isso é muito importante para a distribuição eletrônica, nos ajudando a compreender qual a camada de valência de cada elemento.
Já os elementos que aparecem em um mesmo grupo têm propriedades semelhantes. É o caso do grupo 18, dos Gases Nobres, que são gasosos em condições normais e têm baixa reatividade (isto é, menor tendência a formarem ligações com outros átomos). Ou do grupo 1, dos Metais Alcalinos, que são macios, possuem baixa densidade e baixos pontos de fusão e são altamente reativos.
Vale lembrar que o Hidrogênio é um caso especial: apesar de estar no grupo 1, ele não apresenta características semelhantes a nenhum grupo.
+ 5 carreiras para quem gosta de Química
Outras divisões
1. Entre metais e não-metais
Quanto mais à esquerda da tabela, maior as chances de um elemento ser metálico. São metais todos os elementos até o grupo 12. A partir do grupo 13, a divisão acontece em uma espécie de escadinha formada pelo Boro, Silício, Arsênico, Telúrio e Ástato – todo mundo que está abaixo dessa escada também é metal. Os demais são classificados como não-metais.
Metais têm em comum algumas características: são sólidos em temperatura ambiente (exceto o Mercúrio, que é líquido), têm um brilho metálico, são maleáveis, dúcteis e excelentes condutores de calor e eletricidade.
2. Entre elementos representativos e de transição
Elementos representativos são os que ocupam as bordas da tabela: estão nos grupos 1 e 2 e de 13 a 18. São assim chamados porque costumam ter seus elétrons organizados de uma única maneira, isto é, tendendo a perder ou ganhar sempre o mesmo número de elétrons para atingir a estabilidade na camada de valência (que ocorre quando esta tem 8 elétrons).
Em geral, o número do grupo também reflete a quantidade de elétrons que um elemento representativo terá na sua camada de valência: os Metais Alcalinos têm apenas um, os elementos do grupo 14 (do Carbono) têm 4 e os Gases Nobres têm 8.
Já os elementos de transição são aqueles que possuem elétrons organizados de diferentes formas, formando íons com diferentes cargas. Estão nos grupos 3 a 12 e se dividem entre os elementos de transição externa – aqueles que aparecem na parte principal da tabela periódica – e os elementos de transição interna – as séries dos Lantanídeos e Actinídeos, que saltam da tabela em duas linhas abaixo do trecho principal.
3. Por blocos de distribuição eletrônica
A tabela periódica também pode ser dividida de acordo com a forma que os elétrons de cada elemento ocupam os diferentes níveis e subníveis da eletrosfera. Existem 7 camadas, e cada uma é dividida em 4 subníveis, que levam as letras s, p, d e f.

Os grupos 1 e 2 da tabela também são chamados de bloco s, porque o subnível mais energético que seus elétrons vão ocupar é o s. O mesmo vale para os grupos 13 a 18, cuja distribuição termina no subnível p, para os grupos 3 a 12, que compõem o bloco d e para os elementos de transição interna, que fazem parte do bloco f.
Dentro de cada bloco, a coluna em que o elemento está também indica quantos elétrons esse subnível mais energético vai carregar. O bloco s vai até 2, número máximo de elétrons que esse subnível pode carregar, e assim sucessivamente, com o bloco p se estendendo até 6, o bloco d, até 10 e o bloco f, até 14.
Quer um exemplo? Tomando o Magnésio, cujo número atômico é 12, podemos dizer que:
- Está no período 3, portanto seus elétrons se distribuem até o terceiro nível
- Está no grupo 2, portanto tem 2 elétrons na sua camada de valência
- Está na segunda coluna do bloco s, portanto sua distribuição eletrônica termina no subnível s, com 2 elétrons.
Lembra do Diagrama de Linus Pauling, aquela sequência diagonal de níveis e subníveis que nos permite fazer a distribuição eletrônica de um elemento? Aplicando ele ao Magnésio, teríamos: 1s2 2s2 2p6 3s2. O que confirma aquilo que a tabela periódica já nos mostrou.
Propriedades periódicas
Observando a posição de cada elemento na tabela, também podemos entender suas características. São elas:
- Raio atômico: é a medida do tamanho do átomo, e corresponde à metade da distância entre os núcleos de dois átomos vizinhos. Esse valor aumenta de cima para baixo dentro dos grupos, e da direita para a esquerda nos períodos. Com isso, sabemos que o Frâncio é o elemento de maior raio atômico, e o Hélio, o de menor.
- Eletronegatividade: indica a tendência do átomo em atrair elétrons em uma ligação química. Ela aumenta de baixo para cima nos grupos, e da esquerda para a direita nos períodos. Portanto, o elemento de maior eletronegatividade é o Flúor, e o de menor, o Frâncio (os Gases Nobres são excluídos porque não podem receber elétrons, tendo sua camada de valência já completa).
- Eletropositividade: indica a tendência do átomo em perder elétrons em uma ligação química. Naturalmente, é o oposto da eletronegatividade, ou seja, aumenta de cima para baixo nos grupos e da direita para a esquerda nos períodos.
- Energia de ionização: é a energia mínima necessária para arrancar um elétron de um átomo. Ela aumenta de baixo para cima nos grupos e da esqueda para a direita nos períodos. O Hélio é o elemento que precisa da maior energia para ter um elétron arrancado, e o Frâncio, da menor.
- Afinidade eletrônica: indica a energia liberada quando um átomo recebe um elétron. Ela aumenta de baixo para cima nos grupos e da esquerda para a direita nos períodos. O Flúor é quem libera mais energia ao receber um elétron, e o Frâncio, menos.
Prepare-se para o Enem sem sair de casa. Assine o Curso GUIA DO ESTUDANTE ENEM e tenha acesso a todas as provas do Enem para fazer online e mais de 180 videoaulas com professores do Poliedro, recordista de aprovação nas universidades mais concorridas do país.





 Confira as notas de corte da Fuvest 2025
Confira as notas de corte da Fuvest 2025 Qual é o plural de cuscuz?
Qual é o plural de cuscuz? TRI: três ferramentas para simular sua nota no Enem
TRI: três ferramentas para simular sua nota no Enem Já imaginou sair da faculdade empregado nas melhores empresas da área?
Já imaginou sair da faculdade empregado nas melhores empresas da área? Fuvest 2025: quando sai a lista de aprovados para segunda fase?
Fuvest 2025: quando sai a lista de aprovados para segunda fase?